
【题目】下列说法不正确的有
A. 常温下反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应△H>0
B. H2(g)+I2(g)![]() 2HI(g) △H=-QkJ·mol-1,表示一定条件下有 1molH2和1molI2(g)反应生成2 mol HI (g)时放出QkJ的热量
2HI(g) △H=-QkJ·mol-1,表示一定条件下有 1molH2和1molI2(g)反应生成2 mol HI (g)时放出QkJ的热量
C. 过量铁粉与l00mL0.0lmol·L-1的稀盐酸反应,滴入几滴CuSO4溶液能加快反应速率,但不改变产生H2的量
D. 改变反应条件使化学平衡向正反应方向移动时反应物的转化率一定增大
【答案】D
【解析】A项,反应C(s)+CO2(g)=2CO(g)的ΔS![]() 0,常温下反应不能自发进行说明ΔH
0,常温下反应不能自发进行说明ΔH![]() 0,正确;B项,根据热化学方程式的含义,一定条件下有 1molH2和1molI2(g)反应生成2 mol HI (g)时放出QkJ的热量,正确;C项,Fe与CuSO4溶液发生置换反应生成Cu,Fe、Cu与稀盐酸构成原电池加快反应速率,由于铁粉过量,以H+计算产生H2的量,H+物质的量不变,则产生H2的量不变,正确;D项,改变反应条件使化学平衡向正反应方向移动时反应物的转化率不一定增大,如增大某一反应物的浓度,平衡向正反应方向移动,提高另一反应物的转化率,自身的转化率反而减小,错误;答案选D。
0,正确;B项,根据热化学方程式的含义,一定条件下有 1molH2和1molI2(g)反应生成2 mol HI (g)时放出QkJ的热量,正确;C项,Fe与CuSO4溶液发生置换反应生成Cu,Fe、Cu与稀盐酸构成原电池加快反应速率,由于铁粉过量,以H+计算产生H2的量,H+物质的量不变,则产生H2的量不变,正确;D项,改变反应条件使化学平衡向正反应方向移动时反应物的转化率不一定增大,如增大某一反应物的浓度,平衡向正反应方向移动,提高另一反应物的转化率,自身的转化率反而减小,错误;答案选D。


科目:高中化学 来源: 题型:
【题目】市场上有一种加酶洗衣粉,它是在洗衣粉中加入少量的碱与蛋白酶制成的。蛋白酶的催化活性很强,衣物的汗渍、血迹及人体排放的蛋白质、油渍遇到它,都能水解而除去。下列衣料中,不能用加酶洗衣粉洗涤的是
A. 棉织品 B. 毛织品 C. 腈纶织品 D. 丝织品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碱金属和卤素的说法正确的是( )
A. 从Li到Cs,单质的熔、沸点越来越高
B. 从F到I,单质与H2化合生成的氢化物越来越稳定
C. 从F到I,前一种单质都能把后一种单质从其盐溶液中置换出来
D. 从Li到Cs,最高价氧化物对应的水化物碱性越来越强,单质与水反应越来越剧烈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第一阶段,在30℃和50℃两者之间选择反应温度,选30℃
C. 第二阶段,Ni(CO)4分解率较高
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1的CH3COOH溶液中,下列关系正确的是
A. c(CH3COOH)>c(H+)>c(CH3COO-) >c(OH-)
B. c(CH3COO-)>c(CH3COOH>c(H+) >c(OH-)
C. c(CH3COOH)>c(CH3COO-)=c (H+)>c(OH-)
D. c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了( )
A.该反应是放热反应
B.该反应是吸热反应
C.铁粉和硫粉在常温下可以发生反应
D.硫化亚铁的总能量高于铁粉和硫粉的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: 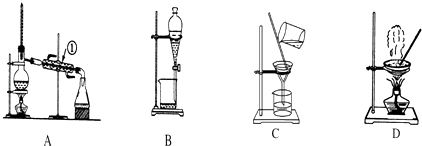
(1)从氯化钾溶液中得到氯化钾固体,选择装置(填代表装置图的字母,下同);除去自来水中的Cl﹣等杂质,选择装置 .
(2)从碘水中分离出I2 , 选择装置 , 该分离方法的名称为 .
(3)装置A中①的名称是 , 进水的方向是从口(上或下)进水.装置B在分液时为使液体顺利滴下,除打开漏斗下端的旋塞外,还应进行的具体操作是 .
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验: [海水] ![]() [粗盐]
[粗盐] ![]() [食盐水]→[氯化钠晶体],粗盐中含Ca2+、Mg2+、Fe3+、SO
[食盐水]→[氯化钠晶体],粗盐中含Ca2+、Mg2+、Fe3+、SO ![]() 等杂质,需要提纯后才能综合利用.粗盐提纯的步骤有:
等杂质,需要提纯后才能综合利用.粗盐提纯的步骤有:
①加入过量的Na2CO3溶液②加入过量的BaCl2溶液③加入过量的NaOH溶液④调节溶液的pH等于7⑤溶解 ⑥过滤⑦蒸发正确的操作顺序是(填选项字母)
a.⑤②③①⑥④⑦b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦d.⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时, A为正极;B与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为
A. A﹥B﹥E﹥DB. A﹥B﹥D﹥EC. D﹥E﹥A﹥BD. D﹥A﹥B﹥E
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com