
| A、一定条件下下向1L容器内通入46gNO2,则NO2 的物质的量浓度一定为1mol/L |
| B、标况下22.4L的己烷中有20NA原子 |
| C、1mol氯气溶于水转移1mol e- |
| D、1molNa2O2与足量水反应,转移1mol e-,生成0.5molO2 |


科目:高中化学 来源: 题型:
 由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.
由于工业发展,燃烧设备不断增多,设备规模不断增大.这些工厂排放的烟气中都会有大量的SO2废气.据统计,我国1995年工业SO2的排放量为1396万吨,2006年工业SO2的排放量达到了3800万吨,由于SO2的污染,我国每年损失高达1100亿元.查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 两级材料 | Zn片、石墨 | Cu片、Ag片 | Zn片、Cu片 | Fe片、Cu片 |
| 插入溶液 | H2SO4溶液 | AgNO3溶液 | 蔗糖溶液 | 稀盐酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若电键K与N连接,铁为负极 |
| B、若电键K与N连接,正极反应式是O2+2H2+4e-═4OH- |
| C、若电键K与M连接,将石墨棒成铜棒,可实现铁棒上镀铜 |
| D、若电键K与M连接,当两极共产生28L(标准状况)气体是,生成了1molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
 研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是( )| A、由TiO2制得1mol金属Ti,理论上外电路转移2 mol电子 |
| B、阳极的电极反应式为:C+2O2--4e-═CO2↑ |
| C、在制备金属钛前后,整套装置中CaO的总量减少 |
| D、若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁的原子失电子能力比钠弱 |
| B、氟的氢化物很稳定 |
| C、硫的氢化物比氧的氢化物更不稳定 |
| D、氢氧化钠是弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、工业上可用电解法制备Mg:MgCl2
| ||||
| B、自然界中正常的雨水呈酸性:H2O+CO2?H2CO3?H++HCO3- | ||||
| C、用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) | ||||
| D、用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
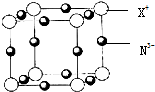 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com