
����Ŀ���Թ�ҵ��ˮ��������ˮ���д����Ƿ�ֹˮ����Ⱦ������ˮ�ʵ���Ҫ��ʩ֮һ��
��1�����᳧�����Է�ˮ����(As)Ԫ��(��Ҫ�� H3AsO3 ��ʽ����)�������ߣ�Ϊ��������ŷţ� ij�������û�ѧ���������������ˮ����ش��������⣺
����֪���ǵ���ͬ��Ԫ�أ��ȵ�ԭ�Ӷ� 2 �����Ӳ㣬����Ԫ�����ڱ���λ��Ϊ_____��
�ڹ�ҵ�ϲ�����(ͨ��������)ȥ����ˮ�е��飬������Ϊ�����Ե������飬�÷� Ӧ�����ӷ���ʽΪ_____��
��2����Ƴ��ķ�ˮ�к��е� CN-�о綾����Ҫ���������ŷš������� CN-��ˮ�ķ���֮һ���� ����������£�CN-������������ HCO3- ��ͬʱ���� NH3���÷�Ӧ�����ӷ���ʽΪ_____��
(3)������������������������Һ��ͬʱ�õ������ԭ����ͼ��ʾ(ͼ����HA����ʾ������ӣ� A�D��ʾ���������)��
�������ĵ缫��ӦʽΪ_____
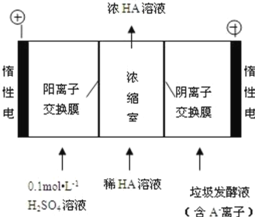
�ڵ������У���ȡһ���Ĵ�ʩ�ɿ��������ҵ� pH ԼΪ 6��8����ʱ����Ũ���ҵ� OH���ɺ��Բ� �ơ�400 mL 10 g��L��1 ������Һͨ��һ��ʱ��� Ũ������Ϊ 145 g/L(��Һ����仯���Բ���)�������ϲ����� H2 �ڱ�״���µ����ԼΪ_____L (��֪�������Ħ������Ϊ 90 g/mol)��
���𰸡��������ڢ�A�� 2H3AsO3+3S2-+6H+=As2S3��+6H2O 4H2O+2CN-+O2=2HCO3-+2NH3 4OH--4e-�T2H2O+O2����2H2O-4e-�TO2��+4H+ 6.72
��������
��1���������ǵ���ͬ��Ԫ�أ��ȵ�ԭ�Ӷ�2�����Ӳ��֪����ԭ���������5�����ӣ�4�����Ӳ㣻
�����������Ϣ��֪�����������£�������ͷ�ˮ�е����ᷴӦ�����������Ե��������ˮ��
��2���������֪��������������£�CN-������������HCO3-��ͬʱ����NH3����Ӧ��̼Ԫ�ػ��ϼ����߱���������Ԫ�ػ��ϼ�û�б仯��
��3����ˮ�������������������������ʧ���ӷ���������Ӧ�����������ƻ�ˮ�ĵ���ƽ�⣬ʹ��Һ�����ԣ�
���ɵ缫��Ӧʽ������HA�Ļ�ѧ����ʽ�ɵã�2HA��2 H+��H2���ɴ˼���ɵá�
��1���������ǵ���ͬ��Ԫ�أ��ȵ�ԭ�Ӷ�2�����Ӳ��֪����ԭ���������5�����ӣ�4�����Ӳ㣬����λ��Ԫ�����ڱ��������ڢ�A�壬�ʴ�Ϊ���������ڢ�A�壻
�����������Ϣ��֪�����������£�������ͷ�ˮ�е����ᷴӦ�����������Ե��������ˮ����Ӧ����������ԭ��������������������Ӧ�����ӷ���ʽΪ2H3AsO3+3S2-+6H+=As2S3��+6H2O���ʴ�Ϊ��2H3AsO3+3S2-+6H+=As2S3��+6H2O��
��2���������֪��������������£�CN-������������HCO3-��ͬʱ����NH3����Ӧ��̼Ԫ�ػ��ϼ����߱���������Ԫ�ػ��ϼ�û�б仯����Ӧ�����ӷ���ʽΪ4H2O+2CN-+O2=2HCO3-+2NH3���ʴ�Ϊ��4H2O+2CN-+O2=2HCO3-+2NH3��
��3����ˮ�������������������������ʧ���ӷ���������Ӧ�����������ƻ�ˮ�ĵ���ƽ�⣬ʹ��Һ�����ԣ���Һ��������Ũ�����缫��ӦʽΪ4OH-��2H2O-4e-�TO2��+4H+���ʴ�Ϊ��4OH--4e-�T2H2O+O2����2H2O-4e-�TO2��+4H+��
���ɵ缫��Ӧʽ������HA�Ļ�ѧ����ʽ�ɵã�2HA��2 H+��H2��������������HA������Ϊ��145 g/L��0.4L��10 g/L��0.4L��=54g������HA�������Ĺ�ϵʽ��֪�����ϲ����� H2 �ڱ�״���µ����ԼΪ![]() ��
��![]() ��22.4L/mol=6.72L���ʴ�Ϊ��6.72��
��22.4L/mol=6.72L���ʴ�Ϊ��6.72��


 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������![]() ������ɱ�����ͨ��������Ϊ��ɫҺ�壬�۵�Ϊ
������ɱ�����ͨ��������Ϊ��ɫҺ�壬�۵�Ϊ![]() ���е�Ϊ
���е�Ϊ![]() ���ڳ�ʪ����������������
���ڳ�ʪ����������������![]() ���Ͽ�ʼ�ֽ⣬���ɶ�����������������ڷ���Ҳ�ɷֽ⣬�Ʊ�ʱ�Ի���̿Ϊ��������Ӧ���Ȼ�ѧ����ʽΪ
���Ͽ�ʼ�ֽ⣬���ɶ�����������������ڷ���Ҳ�ɷֽ⣬�Ʊ�ʱ�Ի���̿Ϊ��������Ӧ���Ȼ�ѧ����ʽΪ![]()
![]() ������װ����ͼ��ʾ�����������������
������װ����ͼ��ʾ�����������������![]()
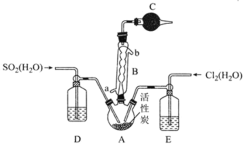
A.����������BӦ��a�ڽ�ˮb�ڳ�ˮ
B.��ͨ���۲�D��E�����ݲ������ʿ���ͨ��A�е�![]() ��
��![]() �������
�������
C.����C��D��E��ʢ�ŵ��Լ�����Ϊ��ˮ�Ȼ��ơ�Ũ���ᡢŨ����
D.���ڷ��õ�������Һ��ᷢ�Ƶ�ԭ�����ܽ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ绯ѧԭ�����л���ˮ�е��Ҷ���[H2N(CH2)2NH2]ת��Ϊ�����ʵ�ԭ��ʾ��ͼ����ͼ1��ʾ��ͬʱ���ø�װ����ʵ�ֶ�ͭ����ʾ��ͼ��ͼ2��ʾ������ع���ʱ������˵����ȷ����

A. ͼ1��H+�����ӽ���Ĥ���������ƶ�
B. ����һ��ʱ���ͼ2��CuSO4��ҺŨ�ȼ�С
C. ��Y�缫����0.5 mol O2ʱ�����缫����64 g
D. X �缫��Ӧʽ:H2N��CH2��2NH2+16e-+4H2O�T2CO2��+N2��+16H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��Cʱ�� Ksp (AgCl)= 1.56��10-10�� Ksp(Ag2CrO4)= 9.0��10-12,����˵����ȷ����
A. AgCl �� Ag2CrO4 ���������Һ����![]()
B. ��Ag2CrO4����Һ�м��� NaCl Ũ��Һ�� Ag2CrO4������ת��Ϊ AgCl
C. �� AgCl ������Һ�м��� NaCl ������ �� AgC1 ��������Һ�� c(Cl��)=c(Ag��)
D. ��ͬŨ�ȵ� Na2CrO4�� NaCl �����Һ�еμ� AgNO3��Һ��AgC1������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������![]() ��һ�ָ�Ч��Ư������������������������������NaCl���ų�
��һ�ָ�Ч��Ư������������������������������NaCl���ų�![]() ��
��![]() ������
������![]() �����ʡ�ij��ȤС��̽���������Ƶ��Ʊ������ʡ�
�����ʡ�ij��ȤС��̽���������Ƶ��Ʊ������ʡ�
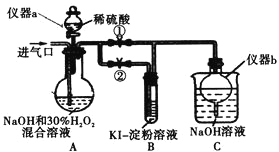
��I���Ʊ���������
�ر�ֹˮ��![]() ����ֹˮ��
����ֹˮ��![]() ���ӽ�����ͨ������
���ӽ�����ͨ������![]() ����ַ�Ӧ��
����ַ�Ӧ��
��1������a������Ϊ_________������b��������_________��
��2��װ��A������![]() �Ļ�ѧ����ʽΪ_________��
�Ļ�ѧ����ʽΪ_________��
��3������װ��A��Ӧ�����Һ�л��![]() ���壬����Ҫ�����У���ѹ����Ũ����________�����ˡ�ϴ�ӡ�����ȡ�
���壬����Ҫ�����У���ѹ����Ũ����________�����ˡ�ϴ�ӡ�����ȡ�
��II��̽���������Ƶ�����
ֹͣͨ![]() ���壬��ͨ�����һ��ʱ��ر�ֹˮ��
���壬��ͨ�����һ��ʱ��ر�ֹˮ��![]() ����ֹˮ��
����ֹˮ��![]() ����A�е���ϡ���ᡣ
����A�е���ϡ���ᡣ
��4����д����ʱA�з�����Ӧ�����ӷ���ʽ_________��
��5����ʼʱA�з�Ӧ�������Ժ������������ʼ���ӿ죬����Ϳ��ܵ�ԭ��_________��
��6��B������Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ұ���������ķ���������Ϊԭ����ȡ��ϸ���������������ܽ��ͻ�����Ⱦ�ֿ��������Դ�������ʡ���֪���ҵ���Ҫ�ɷ�ΪA12O3������������SiO2��FeO��Fe2O3�������Ʊ��������£�

��1������ͼ������������NaOH�����Ʊ������ƣ��ɲ��õ�װ��Ϊ_____����ѡ���ţ���

��2�������м���H2O2�����������ԭ����___________________________________��
��3��ͨ��������Һ��pH�������������õ�Fe��OH��3����֪��
��Fe3+ | ��Fe2+ | ��Al3+ | |
����ʼ����ʱ��pH | ��2.2 | ��7.5 | ��3.7 |
����ȫ����ʱ��pH | ��3.2 | ��9.0 | ��4.7 |
Ϊ��֤��Ʒ�Ĵ��ȣ�����ѡ�����������е�_______������ҺpH������ĸ��������pH�ķ�ΧΪ______________��
a��Al2O3 b��NaOH c��Al��OH��3 d��Na2CO3
��4������������茶��壬��������Ҫ��ӦΪ��4[NH4Al��SO4��212H2O]![]() 2Al2O3+2NH3��+N2��+5SO3��+3SO2��+53H2O��������������ͨ����ͼ��ʾ��װ�ã�
2Al2O3+2NH3��+N2��+5SO3��+3SO2��+53H2O��������������ͨ����ͼ��ʾ��װ�ã�

�ټ���ƿ���ռ�����������____________���ѧʽ����
��װ��KMnO4��Һϴ��ƿ��������____________________________��
��ѡ��һ�ֳ��û�ѧ�Լ���ϡ�������������泥����Լ�_________��д��������識����������Լ������ӷ���ʽ__________________________________________________��
��20��ʱ��0.1mol��L��1������泥�����ҺpH=3,����Һ�У�2c(SO42��)��c(NH4+)��3c(Al3+)=____________mol��L��1����������ּ���ʽ�����ػ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��CO2�ǻ�ʯȼ��ȼ�յ���Ҫ���
��1����֪:2CO(g)+O2(g)=2CO2(g)��H=-566.0kJ/mol������Eo-o=499.0kJ/mol��
�ٷ�Ӧ:CO(g)+O2(g)![]() CO2(g)+O(g)����H=______kJ/mol��
CO2(g)+O(g)����H=______kJ/mol��
����֪2500Kʱ�����з�Ӧ��ƽ�ⳣ��Ϊ0.40��ijʱ�̸÷�Ӧ��ϵ�и�����Ũ������:c(CO)��c(O2)=c(CO2) ��c(O)�����ʱv(��)_____(����>""<"��"=��)v(��)��
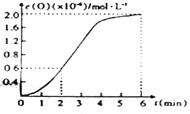
����֪1500��ʱ�����ܱ������з�����Ӧ:CO2(g)![]() CO(g)+O(g)����Ӧ������O(g)�����ʵ���Ũ����ʱ��ı仯����ͼ��ʾ����0~2min�ڣ�CO2��ƽ����Ӧ����v(CO2)=______�����������������Ϊ10-6��
CO(g)+O(g)����Ӧ������O(g)�����ʵ���Ũ����ʱ��ı仯����ͼ��ʾ����0~2min�ڣ�CO2��ƽ����Ӧ����v(CO2)=______�����������������Ϊ10-6��
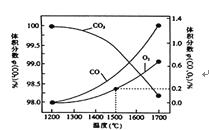
��2����ij�ܱ������з�����Ӧ��2CO2(g)![]() 2CO(g)+O2(g),1molCO2�ڲ�ͬ�¶��µ�ƽ��ֽ�������ͼ��ʾ��
2CO(g)+O2(g),1molCO2�ڲ�ͬ�¶��µ�ƽ��ֽ�������ͼ��ʾ��
�ٺ��º��������£��ܱ�ʾ�ÿ��淴Ӧ�ﵽƽ��״̬����___(����ĸ).
A��CO������������ֲ���
B�������ڻ��������ܶȱ��ֲ���
C�������ڻ�������ƽ��Ħ���������ֲ���
D����λʱ���ڣ�����CO��Ũ�ȵ�������CO2��Ũ��
�ڷ�����ͼ����1500��ʱ��Ӧ�ﵽƽ��״̬�����������Ϊ1L�����ʱ��Ӧ��ƽ�ⳣ��K=____(����������1λС��)��
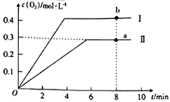
����2L�ĺ����ܱ������г���2molCO2(g)��������Ӧ��2CO2(g)![]() 2CO(g)+O2(g)������¶�ΪT��ʱ��������O2�����ʵ���Ũ����ʱ��ı仯����ͼ����II��ʾ��ͼ������I��ʾ���������II���ı�һ�ַ�Ӧ������c(O2)��ʱ��ı仯����ı��������___��a��b������COŨ�ȱ仯��ʾ������Ӧ���ʹ�ϵΪva(CO)_____(����>����<������=��)vb(CO)��
2CO(g)+O2(g)������¶�ΪT��ʱ��������O2�����ʵ���Ũ����ʱ��ı仯����ͼ����II��ʾ��ͼ������I��ʾ���������II���ı�һ�ַ�Ӧ������c(O2)��ʱ��ı仯����ı��������___��a��b������COŨ�ȱ仯��ʾ������Ӧ���ʹ�ϵΪva(CO)_____(����>����<������=��)vb(CO)��
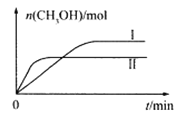
��3��CO2��H2����һ��������ܱ������У��������¶��·�����Ӧ��CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g)���CH3OH�����ʵ�����ʱ��ı仯��ͼ������I�����Ӧ��ƽ�ⳣ����С��ϵΪK��___K��������>������=������<������
CH3OH(g) +H2O(g)���CH3OH�����ʵ�����ʱ��ı仯��ͼ������I�����Ӧ��ƽ�ⳣ����С��ϵΪK��___K��������>������=������<������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������,��HC1����ͨ�뵽1LŨ�Ⱦ�Ϊ0.1mol/L��NaA��NaB�Ļ����Һ�У������Һ��pH������Ũ�ȱ仯�Ĺ�ϵ��ͼ��ʾ(������Һ����ı仯)��������������ȷ����
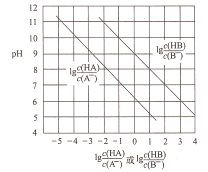
A. Ka(HB)��������Ϊ10-9
B. ���Ե�ǿ��˳��ΪHCl>HA>HB
C. ��ͨ��0.1molHC1����ʱ��c(B-)>c(A-)
D. �������Һ������ʱ,c(Na+)=c(Cl-)+c(A-)+c(B-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��һ����������������Ũ�ȹ���ʱ�����ֽ⣬�������Ʊ���NaClO2�����Ա���������档�������ⷨ�Ʊ�NaClO2�����ʵ��װ����ͼ��ʾ��

��֪��2NaClO3��H2O2��H2SO4=2ClO2����O2����Na2SO4��2H2O
2ClO2��H2O2��2NaOH=2NaClO2��O2����2H2O
ClO2�۵㣭59 �����е�11 ����H2O2�е�150 ����
��ش�
(1)����A������Ϊ________������B��������________����ˮԡ��ȴ��Ŀ����____________(д������)��
(2)�������ٹ���������������NaClO2���ʣ��Խ�����ԭ��______________��
(3)Cl������ʱ���ClO2�����ɡ���Ӧ��ʼʱ��������ƿ�м����������ᣬClO2���������ʴ����ߣ����������������ù��̿��ܾ�������Ӧ��ɣ����䲹����������_______________________________(�����ӷ���ʽ��ʾ)����H2O2��Cl2=2Cl����O2��2H����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com