
(14分)长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定亚硫酸钠试剂被氧化的程度,设计了下图实验,请回答下面的问题: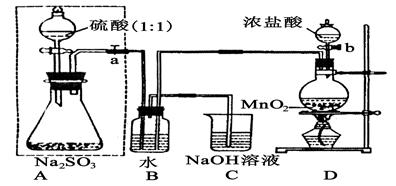
(1)D装置中反应的化学方程式为 。
B装置中反应的离子方程为 。
(2)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应、过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为: 。
(3)为保证实验测定的准确性,A中的硫酸什么时候滴加
C装置中的作用是 _________________。
(4)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3)2溶液,请从中选择合适试剂,设计一种不同的实验方法,测定试样中无水亚硫酸钠被氧化的程度,你使用试剂的顺序为: 。(填试剂编号)
(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O Cl2+SO2+2H2O=4H++2Cl-+SO42-
MnCl2+Cl2↑+2H2O Cl2+SO2+2H2O=4H++2Cl-+SO42-
(2)
(3)待B中水面上方充满了黄绿色的气体 吸收尾气,防止污染大气
(4)①②④
解析试题分析:(1)装置D是制氯气的装置,发生的反应为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,装置B是氯气氧化SO2的反应,方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-。
MnCl2+Cl2↑+2H2O,装置B是氯气氧化SO2的反应,方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-。
(2)得到的bg沉淀是BaSO4,根据Na2SO3—SO2—BaSO4,可知Na2SO3为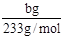 =
= 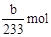 ,所以Na2SO3的质量分为数为
,所以Na2SO3的质量分为数为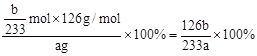 。
。
(3)保证实验的准确性就是不让SO2流失掉,所以硫酸应该在B中水面上方充满了黄绿色的气体的时候滴加。C中的NaOH是吸收尾气,防止污染大气。
(4)另外一种设计方案是将Na2SO3溶于水,然后向其中加入稀盐酸至不再产生气体为止,在加BaCl2溶液,然后将生成的沉淀过滤洗涤干燥称量其质量,求出Na2SO4的质量分数,继而求得Na2SO3的质量分数。所以使用试剂的顺序是①②④。
考点:SO2与Cl2的性质
点评:本题综合性强,主要考查学生分析实验设计实验的能力。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源:2012届四川省成都市高三第二次诊断性检测理综试卷(带解析) 题型:填空题
(14分)巳知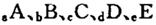 元索,
元索,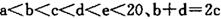 。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
(1) B的原子结构示意图为_________;E在元素周期表中的位置________。
(2) 已知C2及其化合物有以下转化关系(部分物质已省略):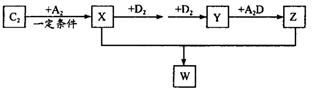
①将已收集满气体Y的试管管口倒扣在水面下,可以观察到的现象是________;其化学反应方程式为________; W的晶体类型为________;将E单质与Z的极稀溶液混合,还原产物只有W,则该反应的离子方程式为________________________。
②上述合成X的反应处于平衡状态时,气体X的浓度为C(X)(如图)。在恒温恒容条件下,t1时刻通人X将X的浓度变为2c(X)。请在下图画出平衡移动过程中X浓度的变化趋势图。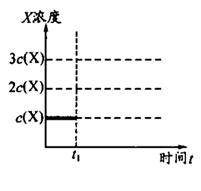
(3) 由其中三种元素形成的只含极性键、具有18电子的共价化合物为________ (写结构简式,至少2种)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省四地六校高三第三次月考化学试卷(解析版) 题型:实验题
(14分)长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定亚硫酸钠试剂被氧化的程度,设计了下图实验,请回答下面的问题:
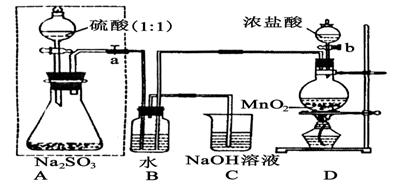
(1)D装置中反应的化学方程式为 。
B装置中反应的离子方程为 。
(2)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应、过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为: 。
(3)为保证实验测定的准确性,A中的硫酸什么时候滴加
C装置中的作用是 _________________。
(4)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3)2溶液,请从中选择合适试剂,设计一种不同的实验方法,测定试样中无水亚硫酸钠被氧化的程度,你使用试剂的顺序为: 。(填试剂编号)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省成都市高三第二次诊断性检测理综试卷(解析版) 题型:填空题
(14分)巳知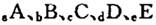 元索,
元索,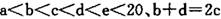 。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
(1) B的原子结构示意图为_________;E在元素周期表中的位置________。
(2) 已知C2及其化合物有以下转化关系(部分物质已省略):
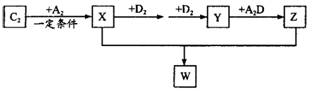
①将已收集满气体Y的试管管口倒扣在水面下,可以观察到的现象是________;其化学反应方程式为________; W的晶体类型为________;将E单质与Z的极稀溶液混合,还原产物只有W,则该反应的离子方程式为________________________。
②上述合成X的反应处于平衡状态时,气体X的浓度为C(X)(如图)。在恒温恒容条件下,t1时刻通人X将X的浓度变为2c(X)。请在下图画出平衡移动过程中X浓度的变化趋势图。
(3) 由其中三种元素形成的只含极性键、具有18电子的共价化合物为________ (写结构简式,至少2种)。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)长期存放的Na2SO3,会被空气中的氧气部分氧化。某化学兴趣小组通过实验测定某无水Na2SO3,被氧化的程度。
(Ⅰ)甲同学设计了下图实验。

请回答:
(1)写出B装置中反应的离子方程式 ;
(2)写出D装置中反应的化学方程式 ;
(3)若起始实验时称量出放入锥形瓶中Na2SO3样品质量为a g,实验后向B装置的溶液中加入足量BaCl2溶液充分反应,过滤、洗涤、干燥、称量得白色沉淀b g,则样品中Na2SO3的质量分数为 ;
(4)深入研究发现,上述实验方案存在缺陷,致使测得的Na2SO3,质量分数偏小,试分析其中的原因(列出一条即可) 。
(Ⅱ)乙同学设计了另一套实验装置如下图:

(5)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 ;
(6)除已称量的a g Na2SO3,样品外,实验中还应测定的数据是 处(填图中字母)装置实验前后的质量差。
(Ⅲ)现有以下试剂:蒸馏水、盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液。
(7)丙同学欲从中选择合适试剂,来测定已知质量为ag的Na2SO3,样品中Na2SO3的质量分数,下述实验方案理论上可行的有 。
A. 将样品溶解,加足量盐酸,再加足量BaCl2溶液,过滤、洗涤、干燥、称量得沉淀m
B.将样品溶解,加足量硝酸,再加足量BaCl2溶液,过滤、洗涤、干燥、称量得沉淀m2 g
C.将样品溶解,加过量BaCl2溶液,过滤后,将滤液蒸干,称量得固体m3 g
D.将样品溶解,加过量Ba(NO3)2溶液,过滤、洗涤,在沉淀中加入足量盐酸,再过滤、洗涤、于燥、称量得固体m4 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com