
【题目】大气中可吸入颗粒物PM2.5主要来源为燃煤、机动车尾气等。
(1)若取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42-、NO3-、Cl-,该溶液呈酸性,其原因用离子方程式解释是:____________。
(2)“洗涤”燃煤烟气可减轻PM2.5中SO2的危害,下列可适用于吸收SO2的试剂有(____)
a.CaCl2溶液 b.氨水 c.Ca(OH)2悬浊液 d.浓H2SO4
(3)煤烟气中的氮氧化物可用CH4催化还原成无害物质。若常温下,1molNO2与CH4反应,放出477.5kJ热量,该反应的热化学方程式是 __________ 。
(4)安装汽车尾气催化转化器也可减轻PM2.5的危害,其反应是:2NO(g) + 2CO(g)![]() 2CO2(g) + N2(g);△H<0。该反应平衡常数表达式K= ________;温度升高K值______(填“增大”或“减小” )
2CO2(g) + N2(g);△H<0。该反应平衡常数表达式K= ________;温度升高K值______(填“增大”或“减小” )
【答案】 NH4++H2O![]() NH3·H2O+H+ b c 2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l) △H= -955kJ/mol
NH3·H2O+H+ b c 2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l) △H= -955kJ/mol ![]() 减小
减小
【解析】试题分析:本题考查NH4+水解离子方程式的书写,SO2的吸收,热化学方程式的书写,化学平衡常数表达式的书写和影响化学平衡常数的因素。
(1)该溶液呈酸性的原因是NH4+发生水解,水解的离子方程式为:NH4++H2O![]() NH3·H2O+H+。
NH3·H2O+H+。
(2)a项,CaCl2溶液不能吸收SO2;b项,氨水能吸收SO2,反应的化学方程式为:SO2+2NH3·H2O=(NH4)2SO3+H2O;c项,Ca(OH)2悬浊液能吸收SO2,反应的化学方程式为:SO2+Ca(OH)2=CaSO3↓+H2O;d项,浓H2SO4不能吸收SO2;适用于吸收SO2的试剂是氨水和Ca(OH)2悬浊液,答案选bc。
(3)煤烟气中的氮氧化物被CH4催化还原成无害物质,氮氧化物被还原成N2,CH4被氧化成CO2;CH4与NO2反应的化学方程式为CH4+2NO2![]() CO2+N2+2H2O;1molNO2与CH4反应放出477.5kJ热量,则2mol NO2与CH4反应放出477.5kJ
CO2+N2+2H2O;1molNO2与CH4反应放出477.5kJ热量,则2mol NO2与CH4反应放出477.5kJ![]() 2=955kJ热量,常温下水呈液态,反应的热化学方程式为2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l) △H= -955kJ/mol。
2=955kJ热量,常温下水呈液态,反应的热化学方程式为2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l) △H= -955kJ/mol。
(4)根据化学平衡常数的概念,该反应平衡常数表达式K=![]() 。由于该反应的正反应为放热反应,温度升高,平衡向逆反应方向移动,K值减小。
。由于该反应的正反应为放热反应,温度升高,平衡向逆反应方向移动,K值减小。


科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Br-、Cl-、CrO42- B. Cl-、Br-、CrO42-
C. CrO42-、Br-、Cl- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中两种气体的分子数一定相等的是
A.质量相等的N2和COB.体积相等的O2和N2
C.氧原子数相等的CO2和COD.原子总数相等的O2和N2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组研究采用BMED 膜堆(示意图如右),模拟精制浓海水为原料直接制备酸碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜(A、D)。已知: 在直流电源的作用下,双极膜内中间界面层发生水的解离,生成H+和OH-。下列说法错误的是( )
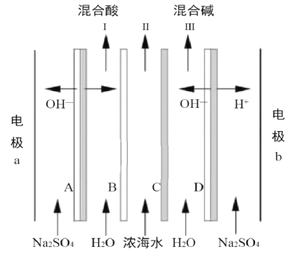
A. 电极a连接电源的正极 B. B为阳离子交换膜
C. 电解质溶液采用Na2SO4溶液可避免有害气体的产生 D. Ⅱ排出的是淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是( )
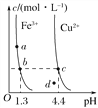
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯是一种广谱杀菌消毒剂,有众多的用途,工业上制取二氧化氯的化学方程式如下:2NaClO3+ 2NaCl+2H2SO4![]() 2ClO2↑+Cl2↑+2H2O+2Na2SO4。
2ClO2↑+Cl2↑+2H2O+2Na2SO4。
(1)完成下列计算:0.2 mol NaClO3完全反应,得到气体的体积为__________L(标准状况)。
(2)将27.0 g ClO2溶于水得0.5 L溶液,则ClO2的物质的量浓度为__________mol/L。
(3)为使上述反应产生的Cl2转化为ClO2,将得到的混合气体和NaClO2反应,反应方程式为:2NaClO2 + Cl2![]() 2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)_____。
2ClO2+2NaCl。假设NaClO3的转化率为90%,Cl2的转化率为95%,计算由0.2 mol NaClO3最终可制得的ClO2的质量(保留两位小数)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理对生产有重大的指导意义。回答下列问题:
(1)有两个温度相同的密闭容器A和B,容器A保持容积不变,容器B保持压强不变,起始时向容积相等的A、B中分别充入等量的C(碳)和H2O(g),发生反应:C(s)+H2O(g)![]() CO(g)+ H2(g) (正反应为吸热反应),并分别达到平衡。
CO(g)+ H2(g) (正反应为吸热反应),并分别达到平衡。
①H2O的体积分数:V(A)%_____V(B)%。(填“>”、“<” “=”)
②达到平衡后,在两容器中分别通入等量的氦气,则A中H2O的转化率_______(填“增大” “减小”、“不变”);B中化学平衡_________移动(填“不”“向正反应方向”“向逆反应方向”)。
(2)某温度下,测得0.01mol·L-1 NaOH溶液的pH=10,则在该温度下Kw=______;在此温度下,将pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得溶液为中性,则a:b=_______(假设混合时体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关纯羊毛线的叙述,正确的是( )
A. 组成纯羊毛线的基本单位是核苷酸
B. 纯羊毛线形成过程中一定有水产生
C. 纯羊毛服装可以用加入蛋白酶的洗衣粉清洗
D. 纯羊毛线中一定含有的化学元素是C、H、O、N、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂就能鉴别CaCl2、NH4Cl、Na2SO4、(NH4)2SO4四种溶液,此试剂是( )
A.Ba(OH)2
B.NaOH
C.HCl
D.Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com