
【题目】一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)![]() SiO2(s)+4HF(g)+148kJ
SiO2(s)+4HF(g)+148kJ
(1)写出该反应的平衡常数表达式:K=___________,若0~20min内,固体质量增加了6g,则20min内,用H2O表示该反应的平均速率是______________。
(2)下列各项中能说明该反应已达化学平衡状态的是_______(填字母序号)。
a. v正(SiF4)=4v逆(HF) b. c(SiF4):c(H2O)=1:2
c. 容器内气体的总质量不再变化 d. HF的体积分数不再变化
【答案】![]() 0.01mol/(Lmin) cd
0.01mol/(Lmin) cd
【解析】
![]() ,说明该反应是放热反应,分析时要注意二氧化硅的状态是固体。
,说明该反应是放热反应,分析时要注意二氧化硅的状态是固体。
(1)平衡常数等于生成物平衡浓度的系数次幂比反应物平衡浓度的系数次幂,固体和纯液体不列入平衡常数表达式,故该反应的平衡常数![]() ,固体质量增加了6g,说明生成了6g(0.1mol)二氧化硅,水的物质的量变化为0.2mol,
,固体质量增加了6g,说明生成了6g(0.1mol)二氧化硅,水的物质的量变化为0.2mol,![]() ,
,
故答案为:![]() ;0.01mol/(Lmin);
;0.01mol/(Lmin);
(2)
a.![]() ,正逆反应速率不相等,a错误;
,正逆反应速率不相等,a错误;
b.若初始加入量按照系数比加入,则![]() 始终等于1:2,不能说明达到平衡状态,b错误;
始终等于1:2,不能说明达到平衡状态,b错误;
c.因二氧化硅为固体, 所以容器内的气体总质量是一个变量,当它不再变化说明达到了平衡状态,c正确;
d.![]() 的体积分数是一个变量,当它不再变化说明达到了平衡状态,d正确;
的体积分数是一个变量,当它不再变化说明达到了平衡状态,d正确;
答案选cd。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】Hg 是水体污染的重金属元素之一。水溶液中的二价汞的主要存在形态与Cl-、OH-的浓度关系如图所示[图中涉及的物质或粒子只有Hg(OH)2 为难溶物,粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-1gc(Cl-)]:

下列说法中错误的是
A. Hg(NO3)2固体溶于水通常会出现浑浊
B. 海水Cl-的浓度大于0.1mol/L,则其中汞元素的主要存在形态是Hg(OH)2
C. 少量Hg(NO3)2溶于0.001moL/L盐酸后得到澄清透明溶液
D. 已知Ksp(HgS)=1.6×10-52,当c(S2-)=1×10-5mo/L 时,c(Hg2+)=1.6×10-47mo/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后向其中滴加0.1mol/LNaOH溶液。整个实验过程中溶液的pH变化曲线如图所示,不考虑次氯酸分解,下列叙述正确的是
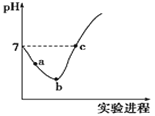
A.实验过程中用pH试纸测定溶液的pH
B.a~b段,溶液中![]() 减小
减小
C.b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-)
D.c点对应溶液中:c(Na+)=c(Cl-)+c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。
(一)CO2的化学捕获:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为___(写含碳粒子符号)。(室温下,H2CO3的Ka1=4.3×10﹣7;Ka2=5.6×10﹣11)
(2)固体氧化物电解池(SOEC)用于高温共电解CO/H2,既可实现CO2的减排又可高效制备合成气(CO/H2),其工作原理如图。写出电极A发生的电极反应式___。

(二)CO2的综合利用
(1)CO2与CH4经催化重整制得合成气:
反应Ⅰ.CH4(g)H+CO2(g)2CO(g)+2H2(g)△H1
已知氢气、一氧化碳和甲烷的标准燃烧热(25℃)如表所示
物质 | H2(g) | CO(g) | CH4(g) |
标准燃烧热△H/kJmol﹣1 | ﹣285.8 | ﹣283.0 | ﹣890.3 |
则反应I的△H=___kJmol﹣1。
(2)用CO2催化加氢制取二甲醚的反应为:反应Ⅱ.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),在10L恒容密闭容器中,均充入2mol CO2和6moH2,分别以铱(Ir)和铈(Ce)作催化剂,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1。
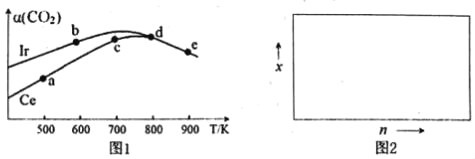
①根据图1,下列说法不正确的是___。
A.反应Ⅱ的△H<0,△S<0
B.用Ir和Ce作催化剂时,反应Ⅱ的活化能更低的是Ce
C.状态d时,v(正)<v(逆)
D.从状态b到d,α(CO2)先增大后减小,减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=___。
③若H2和CO2的物质的量之比为n:1,900K时相应平衡体系中二甲醚的物质的量分数为x,请在图2中绘制x随n变化的示意图。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,将
时,将![]() 溶液逐滴滴加到
溶液逐滴滴加到![]() 溶液中,所得溶液的
溶液中,所得溶液的![]() 与滴加
与滴加![]() 的体积关系如右图所示。下列指定溶液浓度关系说法正确的是
的体积关系如右图所示。下列指定溶液浓度关系说法正确的是
已知:![]() ,
,![]() 时
时![]() 的
的![]() ,
,![]() 。
。
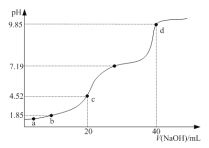
A.![]() 点所得溶液中:
点所得溶液中:![]()
B.![]() 点所得溶液中:
点所得溶液中:![]()
C.![]() 点所得溶液中:
点所得溶液中: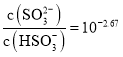
D.![]() 点所得溶液中:
点所得溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/LNa2SO3溶液先升温再降温,测定温度变化过程中的pH,数据如下:
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
(1)①时刻Na2SO3溶液中水的电离程度________同温下纯水中水的电离程度(填“>”、“<”或“=”);应用平衡原理解释该原因_______________________________。
(2)④的pH略小于①是由于_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜改革国外的纯碱生产工艺,创造了侯德榜制碱法又叫联碱法,该法是将合成氨工厂生产的NH3及副产品CO2,再与饱和食盐水反应.
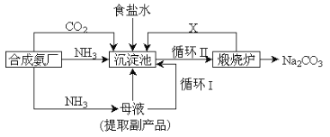
(1)该法与氨碱法比大大提高了原料利用率,主要表现在_______。
(2)碳酸氢钠分解产生的二氧化碳可循环使用,但必须要补充,补充的主要原因是_________,但实际生产中补充量超过理论上反应耗用量,可能的原因是______。
(3)氨碱法需补充的二氧化碳一定来自_________。那么联合制碱需补充的二氧化碳可能来自__________。
(4)侯德榜法在滤去碳酸氢钠的母液中通氨气并加入细小食盐颗粒,冷却析出副产品,通氨气的作用____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组欲探究己烷的性质,用己烷进行下列实验:
实验1:
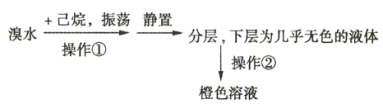
实验2:将上述橙色溶液装入密封性好的无色试剂瓶中。过一段时间,溶液颜色变浅,打开瓶盖瓶口出现白雾。
实验3:利用如图所示实验装置在一定条件分解己烷(生成丙烷和丙烯![]() ),且丙烯能被酸性
),且丙烯能被酸性![]() 溶液氧化。
溶液氧化。
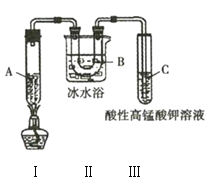
(1)实验1中用到的玻璃仪器主要有______________________________________(填名称)。
(2)由实验1可知,己烷的物理性质有____________________________________。
(3)实验2中的橙色溶液逐渐变浅的原因是__________________(填序号)。
A.己烷与溴发生了取代反应
B.溴代己烷为无色物质
C.液溴向外挥发浓度降低
D.己烷与液溴发生了加成反应
E.液溴与己烷分层,密度大的液溴在下层
(4)实验3中装置Ⅱ的作用是______________________________________。
(5)试管C中的现象是______________________________________。
(6)试写出装置Ⅰ中发生的生成丙烷和丙烯的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,一定不能自发进行的是( )
A. 2KClO3(s)===2KCl(s)+3O2(g) ΔH=-78.03kJ/mol ΔS=1110 J/(mol·K)
B. CO(g)===C(s,石墨)+![]() O2(g) ΔH=110.5kJ/mol ΔS=-89.36 J/(mol·K)
O2(g) ΔH=110.5kJ/mol ΔS=-89.36 J/(mol·K)
C. 4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3kJ/mol ΔS=-280.1 J/(mol·K)
D. NH4HCO3(s)+CH3COOH(aq)===CO2(g)+CH3COONH4(aq)+H2O(l) ΔH=37.301kJ/mol ΔS=184.05 J/(mol·K)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com