解:问题1、问题1:反应物中有氧化铝固体可能未反应完而留在AlN中.
故答案为:氧化铝.
问题2:(1)①由于AlN跟氢氧化钠溶液反应生成NaAlO
2、并放出NH
3,其反应方程式为:AlN+NaOH+H
2O=NaAlO
2+NH
3↑.
故答案为:AlN+NaOH+H
2O=NaAlO
2+NH
3↑.
②生成NH
3的物质的量为
=0.15mo,根据氮元素守恒可知10.00g样品中含有AlN的物质的量为0.15mol,质量为0.15mol×41g/mol=6.15g,该样品中的AlN的质量分数为

×100%=61.5%.
故答案为:61.5%.
(2)反应产物可能CO
2、CO或CO
2和CO、CO
2和O
2的混合气体,根据气体产物的密度可计算出气体产物的平均相对分子质量为30,所以生成气体必定是CO
2和CO混合气体.设混合气体中含有CO
2xmol,CO ymol,根据氧原子守恒有2x+y=0.18…①,根据平均相对分子质量有44x+28y=30(x+y)…②,联立方程解得:x=0.02,y=0.14.所以,样品中C的质量为:(0.02+0.14)×12=1.92g.
故答案为:1.92.
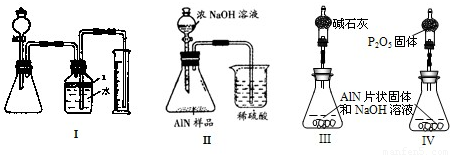
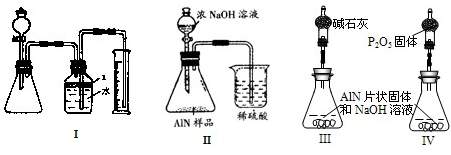
问题3、(1)检查装置的气密性往往是在加药品前进行,否则将可能造成药品的浪费,故先检验气密性,然后在锥形瓶中放入适量的AlN样品,再从分液漏斗往锥形瓶中加入过量的浓NaOH,测定收集到水的体积.
故答案为:③①②④.
(2)检查气密性的关键是整个体系要处于密闭状态,常用的方法有:密封气体利用气体的热胀冷缩或液封气体形成液面高度差.由装置可知,适合利用气体热胀冷缩.具体操作为:关闭分液漏斗活塞,微热锥形瓶,广口瓶中右侧导管水柱上升,恒温时水柱并不回落.
故答案为:关闭分液漏斗活塞,微热锥形瓶,广口瓶中右侧导管水柱上升,恒温时水柱并不回落.
(3)A、苯易挥发,会浪费试剂、影响氨气体积测定,故A不适用;
B、酒精易挥发,挥发出来的气体对实验有影响,同时由于酒精易溶于水,也不能达到隔离的目的,故B错误;
C、植物油既不溶于水,密度小于水也不易挥发,可以把氨气与水进行隔离,故C最好;
D、CCl4密度大于水,不能起到隔离作用,故D错误.
故答案为:C;
(4)本次实验的目的在于测定产生气体的体积而不是收集纯净的气体,氨气排出装置的气体,按占据原来气体空间,广口瓶内的液体是否充满不影响所收集到的NH
3体积大小.
故答案为:不变.
(5)氨气的体积为aL(标况下)的物质的量为
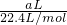
=
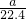
mol,由方程式AlN+NaOH+H
2O=NaAlO
2+NH
3↑可知,样品中AlN的物质的量为=
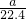
mol,所以AlN的质量为
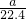
mol×41g/mol=
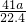
g,样品中AIN的质量分数为
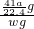
×100%=
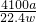
%.
故答案为:
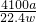
%.
(6)由于AlN中的杂质可能是碳和Al
2O
3,而只碳不能与NaOH溶液反应,此时不溶固体为碳,样品中含有的杂质是C.
只要知道碳的质量与氨气的体积,根据氨气体积计算AlN质量,利用碳与AlN的质量之和与样品质量关系,可以确定是否含有其它杂质.
故答案为:碳;碳的质量.
问题4:II中NH
3极易被吸收,发生倒吸现象,同时氨气中含有水蒸气,影响氨气质量的测定,所以不可行.所作的改正为:在装置之间添加盛有碱石灰的干燥管,烧杯导管的末端接一倒扣的漏斗来吸收氨气.
故答案为:不可行;II中NH
3极易被吸收,发生倒吸现象,同时氨气中含有水蒸气,影响氨气质量的测定;在装置之间添加盛有碱石灰的干燥管,烧杯导管的末端接一倒扣的漏斗来吸收氨气.
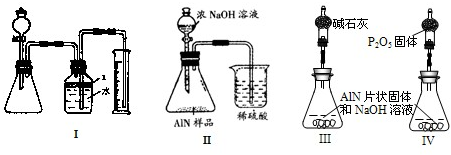
问题5:通过测定氨气的质量(即实验中硫酸增重量)来推算氮化铝的质量.因为有一部分氨气留在锥形瓶中,反应产生的氨气无法全部被稀硫酸吸收,因此实验测得AlN的质量分数将偏小.
戊同学设计的装置Ⅲ较合理,这是通过反应前后总质量减少来测定AlN的质量分数.这里的干燥管作用是吸收被NH
3带出来的水蒸气(反应放热,更容易使产生的水蒸气被NH
3带走),若用IV,则NH
3被吸收,反应前后几无质量差.
但戊同学仍未考虑到空气中的水蒸气或CO
2的进入,否则,将造成反应后的总质量增大,相当于NH
3的减少,导致结果偏低,故而应再加一个同样的干燥管.
故答案为:反应产生的氨气不可能被完全吸收;III;有; 偏低; 应再接一个与IV装置中完全相同的干燥管(或再接一个装有碱石灰的干燥管也行).
分析:问题1、根据物质不一定完全反应进行判断.
问题2、(1)①由题目信息可知,由于AlN跟氢氧化钠溶液反应生成NaAlO
2、并放出NH
3,据此生成方程式.
②生成0.15molNH
3,根据氮元素守恒可知10.00g样品中含有AlN的物质的量为0.15mol,根据m=nM计算AlN的质量,再根据质量分数定义计算.
(2)反应产物可能CO
2、CO或CO
2和CO、CO
2和O
2的混合气体,根据气体产物的密度可计算出气体产物的平均相对分子质量为30,所以生成气体必定是CO
2和CO混合气体.设混合气体中含有CO
2xmol,CO ymol,根据氧原子守恒和平均相对分子质量的计算,列放出计算x、y的值,样品中n(C)=(x+y)mol,据此计算样品中碳的质量.
问题3、(1)检查装置的气密性往往是在加药品前进行,否则将可能造成药品的浪费.
(2)检查气密性的关键是整个体系要处于密闭状态,常用的方法有:密封气体利用气体的热胀冷缩或液封气体形成液面高度差.具体操作为:关闭分液漏斗活塞,微热锥形瓶,广口瓶中右侧导管水柱上升,恒温时水柱并不回落.
(3)X处在上层,密度比水小,且不容易水、不吸收氨气,用于隔离氨气与水,注意由于苯易挥发,会浪费试剂、影响氨气体积测定.
(4)广口瓶内的液体是否充满不影响所收集到的NH
3体积大小.
(5)计算出氨气的体积为aL的物质的量,再根据方程式计算出AlN的物质的量,进而计算AlN的质量,利用质量分数的定义计算样品中AIN的质量分数.
(6)由于AlN中的杂质可能是碳和Al
2O
3,而只碳不能与NaOH溶液反应,此时的固体体为碳.只要知道碳的质量与氨气的体积,根据氨气体积计算AlN质量,利用碳与AlN的质量之和与样品质量关系,可以确定是否含有其它杂质.
问题4:II中NH
3极易被吸收,发生倒吸现象,同时氨气中含有水蒸气,影响氨气质量的测定,所以不可行.所作的改正为:在装置之间添加盛有碱石灰的干燥管,烧杯导管的末端接一倒扣的漏斗来吸收氨气.
问题5:通过测定氨气的质量(即实验中硫酸增重量)来推算氮化铝的质量.因为有一部分氨气留在锥形瓶中,反应产生的氨气无法全部被稀硫酸吸收,因此实验测得AlN的质量分数将偏小.
戊同学设计的装置Ⅲ较合理,这是通过反应前后总质量减少来测定AlN的质量分数.这里的干燥管作用是吸收被NH
3带出来的水蒸气(反应放热,更容易使产生的水蒸气被NH
3带走),若用IV,则NH
3被吸收,反应前后几无质量差.
但戊同学仍未考虑到空气中的水蒸气或CO
2的进入,否则,将造成反应后的总质量增大,相当于NH
3的减少,导致结果偏低,故而应再加一个同样的干燥管.
点评:该题为典型的样品纯度测验试题,并要求对已有的实验方案的评价,并指出方案不可行的原因以及在已有实验的基础上进行新的实验设计,理解实验原理是关键,是对所学知识的综合运用,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,学习中全面把握基础知识,难度很大.

 2AlN+3CO
2AlN+3CO
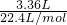 =0.15mo,根据氮元素守恒可知10.00g样品中含有AlN的物质的量为0.15mol,质量为0.15mol×41g/mol=6.15g,该样品中的AlN的质量分数为
=0.15mo,根据氮元素守恒可知10.00g样品中含有AlN的物质的量为0.15mol,质量为0.15mol×41g/mol=6.15g,该样品中的AlN的质量分数为 ×100%=61.5%.
×100%=61.5%.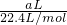 =
=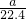 mol,由方程式AlN+NaOH+H2O=NaAlO2+NH3↑可知,样品中AlN的物质的量为=
mol,由方程式AlN+NaOH+H2O=NaAlO2+NH3↑可知,样品中AlN的物质的量为=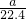 mol,所以AlN的质量为
mol,所以AlN的质量为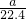 mol×41g/mol=
mol×41g/mol=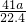 g,样品中AIN的质量分数为
g,样品中AIN的质量分数为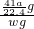 ×100%=
×100%=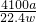 %.
%.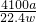 %.
%.

 2AlN+3CO
2AlN+3CO