
【题目】常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )

A. 原合金质量为 0.92 g
B. 产生氧气的体积为896 mL(标准状况下)
C. 图中m的值为1.56
D. 图中V2的值为60
【答案】C
【解析】试题分析:反应后得到20 mL pH=14的溶液,所以n(OH-)=0.02mol,所以需要1mol/L的盐酸20mL来中和,因此V1为20mL,继续加盐酸发生AlO2-+H++H2O=Al(OH)3,Al(OH)3+3H+=Al3++3H2O,因此沉淀AlO2-用掉20mL盐酸,溶解Al(OH)3用掉60mL盐酸,所以V2为100mL。所以Al(OH)3为0.02mol,则m为1.56g,原混合物中含有Al为0.54g,当盐酸加100mL时,溶液中的溶质为NaCl和AlCl3,又知n(Cl-)=0.1mol,n(Al3+)=0.02mol,所以n(Na+)=0.04mol。所以原混合物中有Na为0.04mol,质量为0.92g,所以原混合物的质量为0.92g+0.54g=1.46g。反应过程中产生氢气0.05mol,1120mL,则C正确;答案选C。


科目:高中化学 来源: 题型:
【题目】氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。回答下列问题:
(1)氨气的制备
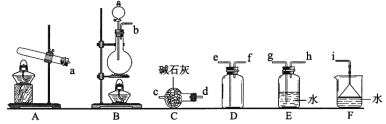
①氨气制取的发生装置可以选择上图中的_________(填字母),反应的化学方程式为_____________________________________________。
②选择上图装置组装一套实验装置来收集一瓶干燥的氨气,所选装置的连接顺序为:发生装置→______→______→______→_____→i(按气流方向,用小写英文字母表示)。
③可用如图装置进行氨的喷泉实验,引发喷泉的操作是_______________________________。
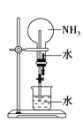
(2)如图所示,NH3经一系列反应可以得到HNO3。

①反应①的化学方程式为________________________________________。
②产物NO是大气污染物之一。在400℃左右且有催化剂存在的情况下,可用氨将一氧化氮还原为无色无毒气体。该反应的化学方程式为_______________________。
(3)在某100mL硝酸与硫酸的混合液中,HNO3和H2SO4的物质的量浓度分别为0.6 mol·L-1和0.3mol·L-1。向该混合液中加入3.84g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 蚕丝、羊毛的主要成分都是蛋白质
B. 蔗糖、油脂及其水解产物均为非电解质
C. 油脂属于天然高分子化合物
D. 牛奶中加入NaCl溶液,会使蛋白质发生变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不合理的是( )
A. 用SO2漂白纸浆和草帽辫 B. 用硫酸清洗锅炉中的水垢
C. NH3易液化,液氨常用作制冷剂 D. 用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U 形管)构成一个原电池如图所示。以下有关该原电池的叙述正确的是( )
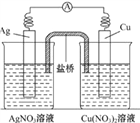
A. 在外电路中,电流由铜电极流向银电极
B. 该装置是将电能转化为化学能
C. 实验过程中取出盐桥,原电池仍继续工作
D. 正极反应为:Ag++e-===Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2 SO2(g)+O2(g)![]() 2SO3(g).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法错误的是( )
2SO3(g).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法错误的是( )
A. 升高温度,可以加快反应速率
B. 在上述条件下,SO2不能完全转化为SO3
C. 使用催化剂是为了加快反应速率
D. 达到平衡时,SO2的浓度与SO3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2% H2O2溶液 | 无 |
② | 10mL5% H2O2溶液 | 无 |
③ | 10mL5% H2O2溶液 | 1mL0.1molL﹣1FeCl3溶液 |
④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1molL﹣1FeCl3溶液 |
⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1molL﹣1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是___________________________________(用过渡态理论来解释);
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为_______________________;
(3)实验①和②的目的是_____________________________________________________;实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是____________________________________;
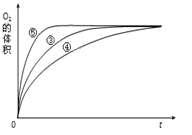
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。 分析图能够得出的实验结论是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湿法炼锌产生的铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。一种由铜镉渣生产金属镉的流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol/L计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 |
(1)浸出过程中,不采用通入空气的方法进行搅拌,原因是防止将Cu氧化浸出,其离子方程式是__________________。
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3。该微电池的正极反应式为_____。
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH。
① 除铁过程中,理论上参加反应的物质n(KMnO4)∶n(Fe2+)=_________。
② 除铁时加入ZnO控制反应液pH的范围为________________。
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证:_____________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com