
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10mL2% H2O2溶液 | 无 |
② | 10mL5% H2O2溶液 | 无 |
③ | 10mL5% H2O2溶液 | 1mL0.1molL﹣1FeCl3溶液 |
④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1molL﹣1FeCl3溶液 |
⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1molL﹣1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是___________________________________(用过渡态理论来解释);
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为_______________________;
(3)实验①和②的目的是_____________________________________________________;实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是____________________________________;
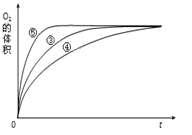
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。 分析图能够得出的实验结论是_________________________________________。
【答案】 降低了反应所需的活化能 H2O2![]() H++HO2-; 探究浓度对反应速率的影响 向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中); 碱性环境能增大 H2O2分解的速率,酸性环境能减小H2O2分解的速率
H++HO2-; 探究浓度对反应速率的影响 向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中); 碱性环境能增大 H2O2分解的速率,酸性环境能减小H2O2分解的速率
【解析】(1)催化剂改变反应的途径,降低反应所需的活化能;(3)实验①和②的浓度不同;为了便于比较,应在相同的条件下利用一个变量来比较;(4)由图可知,⑤的反应速率最大,④的反应速率最小,以此来解答。
(1)催化剂改变反应的途径,降低反应所需的活化能,从而加快反应速率,故答案为:降低了反应的活化能;(2)H2O2的电离方程式为H2O2![]() H++HO2-;(3)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中);(4)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率。
H++HO2-;(3)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中);(4)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )

A. 原合金质量为 0.92 g
B. 产生氧气的体积为896 mL(标准状况下)
C. 图中m的值为1.56
D. 图中V2的值为60
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 标况下,11.2LCCl4中含有共价键数目为2NA
B. 1 mol Cl2 与足量的铁反应转移的电子数目是3NA
C. 2molSO2和1mol18O2充分反应,产物中含18O原子数为2NA
D. 18gH218O和2H2O的混合物中,所含中子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行下列实验:
装置 | 操作 | 现象 |
| 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色 |
下列说法合理的是
A.烧杯A中发生反应:3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
B.红棕色气体消失只与NO2和烧杯C中的KI发生反应有关
C.烧杯C中溶液变蓝只与NO2和C中溶液发生反应有关
D.若将铜片换成铁片,则C中的液体也可能变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:1molH2(g)与1molBr2(g)完全反应生成2molHBr(g)时放出72kJ的热量,有关物质的相关数据如下表:则表中a为
化学键 | H-H | Br- Br | H-Br |
断裂1mol化学键需要吸收的能量/kJ | 436 | a | 369 |
A. 200B. 230C. 260D. 404
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼油厂的废碱液含有废油、苯酚钠、碳酸钠等,实验室通过以下四个步骤处理废碱液获取氢氧化钠固体。下列说法正确的是

A. 用装置甲制取CO2并通入废碱液
B. 用装置乙从下口放出分液后上层的有机相
C. 用装置丙分离水相中加入Ca(OH)2产生的CaCO3
D. 用装置丁将滤液蒸发结晶得到NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分, 表中列出10种元素在周期表中的位置,按要求回答下列各题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑧ | ⑩ | ||||||
3 | ① | ③ | ⑤ | ⑥ | ⑦ | ⑨ | ||
4 | ② | ④ |
(1)写出下列序号所代表的元素符号③_____;⑩______
(2)写出⑥的一种用途_________________;常温下可与表中_______单质反应(填化学式
(3)元素④的原子结构示意图为________________________;
(4)⑤和⑨形成的化合物的化学式为:_____________;向该化合物的水溶液里逐滴滴入苛性钠溶液,现象为__________________________________________________.
(5)②⑤⑦⑧的原子半径由大到小的顺序是__________________________(用元素符号表示)
(6)将①⑤同时投入到水中,发生反应的化学方程式有:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Mg条、Al条平行插入一定浓度的NaOH溶液中,用导线、电流计连接成原电池,此电池工作时,下列叙述中正确的是( )
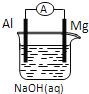
A. Mg比Al活泼,Mg 失去电子被氧化成Mg2+
B. 负极反应式为:Al+4OH--3e-=AlO2-+2H2O
C. 该电池的内外电路中,电流均是由电子定向移动形成的
D. 原电池工作过程中溶液PH不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com