
【题目】在某温度下,将2molA和3molB充入一密闭容器中,发生反应:aA(g)+B(g) ![]() C(g)+D(g),5min后达到平衡,各质的平衡浓度的关系为:[A]a[B]=[C][D]。此时若在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
C(g)+D(g),5min后达到平衡,各质的平衡浓度的关系为:[A]a[B]=[C][D]。此时若在温度不变的情况下将容器的体积扩大为原来的10倍,A的转化率不发生变化,则B的转化率为
A. 60% B. 40% C. 24% D. 4%
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按 ![]() (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | NaOH | NaHCO3 | Na2CO3 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A原子的L电子层比元素B原子的L电子层少 3个电子,B元素原子核外电子总数比A元素原子核外电子总数多5个,则A、B形成的化合物的化学式可能为( )
A.B2A3B.B3A2
C.A2B3D.BA2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种,取该溶液进行连续实验,实验过程如下:

根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是 .能证明该阴离子是否存在的简单实验操作为____ __.
(2)用离子方程表达下列反应:
①中生成气体A: .②中生成溶液H: .
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0ml时开始产生沉淀,55ml时沉淀的量达到最大值0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe2+)为 mol/L、c(Fe3+)为 mol/L、c(Cl﹣)为 mol/L.(若有些离子不存在,请填0mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族, Z、R 、W同周期。下列说法错误的是( )
A. 原子半径:Z>R>W
B. 气态氢化物稳定性:HmW>HnR
C. XW4分子中各原子均满足8电子结构
D. Y、Z、R三种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)
A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略)。
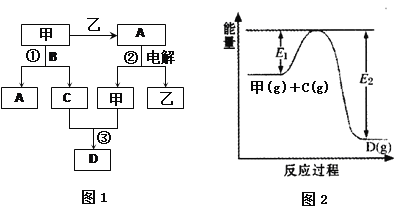
请回答下列问题:
(1)图1所示转化过程中包含的反应类型有 (填字母)。
a.置换反应 b.复分解反应 c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是 。(3分)
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处于平衡状态时,下列措施中有利于提高C的平衡转化率的是 (填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00 mol甲和2.00 mol C混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为
molL-1min-1。
(5)容积均为2 L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
容器编号 | n(甲) | n(C) | n (D) | v正与v逆的关系 |
Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
①若方程式系数为最简整数比,则该温度下的平衡常数K=
填写表中空格: ② ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是

A. 在t℃时,AgBr的Ksp为4.9×10-13
B. 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C. 图中a点对应的是AgBr的不饱和溶液
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1中以CO2表示的化学反应速率为__________(保留小数点后二位数,下同)。
②实验2条件下平衡常数K=_________,该反应为 _____(填“吸”或“放”)热反应。
(3)已知在常温常压下:
① 2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:_____________。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。

①该电池负极的电极反应为:_______________。
②该电池工作时,溶液中的OH-向______极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气细颗粒物吸附的水分中NO2与SO2的化学反应是当前雾霾期间硫酸盐的主要生成路径。某实验小组对雾霾的成分进行了验证,并测定空气中SO2的含量及探究H2SO3的部分性质。
回答下列问题:
(1)硫酸铵是某地PM2.5雾霾的主要成分,收集一定量的雾霾固体进行验证。
取一定量的雾霾固体于试管中,加入适量的水溶解,把溶液分成两份盛于试管中:
操作步骤 | 实验现象 | 结论 |
①向其中一份_______ | 有白色沉淀生成 | 证明雾霾固体中含有SO42- |
②向另一份中_____,用镊子夹持湿润的红色石蕊试纸靠近试管口 | ③试管中有气泡产生,___________________ | 证明雾霾固体中含有NH4+。综合上面实验,初步说明雾霾固休颗粒中含有(NH4)2SO4 |
(2)用如图所示简易装置测定空气中SO2的含量。
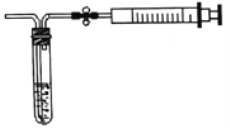
①测定原理:SO2通入碘的淀粉溶液中,使溶液由蓝色变为无色,反应的化学方程式为______。
②测定方法:在某监测点,量取5.0mL5.0×10-4mol/L的碘溶液,注入图中的试管中,加2-3滴淀粉指示剂,此时溶液呈蓝色,按图中装置连接好仪器,利用止水夹控制,进行抽气,取下注射器排气,重复操作直到溶液的蓝色全部褪尽为止,共抽取空气8000.0mL,则测得该监测点空气中SO2的含量为_____mg/L。
(3)探究H2SO3的部分性质。
选用下面的装置和药品探究H2SO3与HClO的酸性强弱
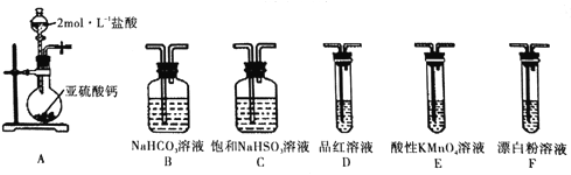
①甲同学认为按照A→C→F→尾气处理的顺序连接装置,可以证明H2SO3与HClO的酸性强弱,乙同学认为该方案不合理,其理由是_________________。
②丙同学采用间接法证明,实验方案为:按照A→C____(其字母) →尾气处理顺序连接装置,其中装置C的作用是___________;证明H2SO3的酸性强于HClO的酸性的实验现象是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com