
����Ŀ������ϸ������������ˮ����NO2��SO2�Ļ�ѧ��Ӧ�ǵ�ǰ�����ڼ������ε���Ҫ����·����ijʵ��С��������ijɷֽ�������֤�����ⶨ������SO2�ĺ�����̽��H2SO3�IJ������ʡ�
�ش�����������
��1���������ij��PM2.5��������Ҫ�ɷ֣��ռ�һ�������������������֤��
ȡһ�����������������Թ��У�����������ˮ�ܽ⣬����Һ�ֳ�����ʢ���Թ���:
�������� | ʵ������ | ���� |
��������һ��_______ | �а�ɫ�������� | ֤�����������к���SO42- |
������һ����_____�������Ӽг�ʪ��ĺ�ɫʯ����ֽ�����Թܿ� | ���Թ��������ݲ�����___________________ | ֤�����������к���NH4+���ۺ�����ʵ��,����˵���������ݿ����к���(NH4)2SO4 |
��2������ͼ��ʾ����װ�òⶨ������SO2�ĺ�����
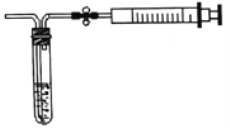
���ⶨԭ����SO2ͨ���ĵ�����Һ�У�ʹ��Һ����ɫ��Ϊ��ɫ����Ӧ�Ļ�ѧ����ʽΪ______��
���ⶨ��������ij���㣬��ȡ5.0mL5.0��10-4mol/L�ĵ���Һ��ע��ͼ�е��Թ��У���2-3�ε���ָʾ������ʱ��Һ����ɫ����ͼ��װ�����Ӻ�����������ֹˮ�п��ƣ����г�����ȡ��ע�����������ظ�����ֱ����Һ����ɫȫ���ʾ�Ϊֹ������ȡ����8000.0mL�����øü��������SO2�ĺ���Ϊ_____mg/L��
��3��̽��H2SO3�IJ������ʡ�
ѡ�������װ�ú�ҩƷ̽��H2SO3��HClO������ǿ��
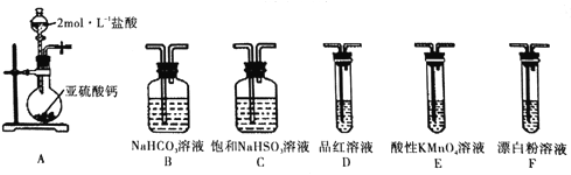
�ټ�ͬѧ��Ϊ����A��C��F��β��������˳������װ�ã�����֤��H2SO3��HClO������ǿ������ͬѧ��Ϊ�÷�������������������_________________��
�ڱ�ͬѧ���ü�ӷ�֤����ʵ�鷽��Ϊ������A��C____(����ĸ) ��β������˳������װ�ã�����װ��C��������___________��֤��H2SO3������ǿ��HClO�����Ե�ʵ��������_____��
���𰸡� ��������ϡ������ټ���BaCl2��Һ ����������NaOHŨ��Һ������ �����Թܿڵĺ�ɫʯ����ֽ����ɫ SO2+I2+2H2O��H2SO4+2HI 0.020 ��������ͨ����������Һ������������ԭ��Ӧ B��E��D��F ��ȥHCl�����������ʵ�� D��Ʒ�첻��ɫ��F�г��ְ�ɫ����
����������1���ڼ���SO42-ʱ�������Ȼ���֮ǰҪ�ȼ��������ų�CO32-���ӵĸ��ţ����ȼ������ữ���������ټ��Ȼ�����Һ�����ְ�ɫ������˵������SO42-������ij��Һ�к���NH4+�IJ�������Ϊ��ȡ�����������뵽�Թ��У���������������Һ���ȣ����Թܿ���ʪ��ĺ�ɫʯ����ֽ����ų����壬��ֽ�ɺ�������ʴ�Ϊ��
�������� | ʵ������ |
��������ϡ������ټ���BaCl2��Һ | |
����������NaOHŨ��Һ������ | �����Թܿڵĺ�ɫʯ����ֽ����ɫ |
��2����SO2ͨ���ĵ�����Һ�У�ʹ��Һ����ɫ��Ϊ��ɫ�����������������������ᣬ��Ӧ�Ļ�ѧ����ʽΪSO2+I2+2H2O��H2SO4+2HI���ʴ�Ϊ��SO2+I2+2H2O��H2SO4+2HI��
�ڶ��������õ���Һ�����գ�����ʽΪ��SO2+I2+2H2O�T2HI+H2SO4��Ϊ�ⶨ�õؿ����е�SO2���������ĵ�����ʵ���=5.0��10-3 L��5��10-4 molL-1=2.50��10-6 mol�����ݻ�ѧ����ʽ�ɵö�����������ʵ���=2.50��10-6 mol������Ϊ2.50��10-6 mol��64g/mol=1.60��10-4 g=0.160mg���ü��������SO2�ĺ���=![]() =0.020 mg/L���ʴ�Ϊ��0.020��
=0.020 mg/L���ʴ�Ϊ��0.020��
��3���ٰ���A��C��F˳������װ�ã����б��͵����������Ƴ�ȥHCl����������ͨ����������Һ������������ԭ��Ӧ������֤��ǿ���Ʊ������ԭ��������֤��������ʹ����������ǿ�����ʴ�Ϊ����������ͨ����������Һ������������ԭ��Ӧ������֤��ǿ���Ʊ������ԭ����
�ڴ��������ǿ�����ԡ�����������л�ԭ�ԣ��������ö���������������ֱ�ӷ�Ӧ�ж�������������������ǿ��������֤���������Ա�̼��ǿ���ٽ��̼�����Ա�HClOǿ�����ж���Aװ���Ʊ������������������ӷ����Ʊ��Ķ��������л���HCl���ñ��͵����������Ƴ�ȥHCl����ͨ��̼��������Һ��������֤���������Ա�̼��ǿ�������Ը��������Һ������ȥ������̼�еĶ���������Ʒ����Һ���������̼�ж��������Ƿ��������ͨ��F�У���װ������˳��ΪA��C��B��E��D��F������װ��C�������dz�ȥHCl���壬D��Ʒ�첻��ɫ��F�г��ְ�ɫ��������֤�������������ǿ�ڴ����ᣬ�ʴ�Ϊ��B��E��D��F����ȥHCl��������Ӱ������ʵ���ã�װ��D��Ʒ�첻��ɫ��F�г��ְ�ɫ������


 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�¶��£���2molA��3molB����һ�ܱ������У�������Ӧ��aA(g)+B(g) ![]() C(g)+D(g)��5min��ﵽƽ�⣬���ʵ�ƽ��Ũ�ȵĹ�ϵΪ��[A]a[B]=[C][D]����ʱ�����¶Ȳ��������½��������������Ϊԭ����10����A��ת���ʲ������仯����B��ת����Ϊ
C(g)+D(g)��5min��ﵽƽ�⣬���ʵ�ƽ��Ũ�ȵĹ�ϵΪ��[A]a[B]=[C][D]����ʱ�����¶Ȳ��������½��������������Ϊԭ����10����A��ת���ʲ������仯����B��ת����Ϊ
A. 60% B. 40% C. 24% D. 4%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.�������и����������������ݣ��ɷֱ��������Һ�ġ�������������������Һ�ġ����ʵ���Ũ�ȡ������жϲ���⡣
(1)��֪ij����������ҺV L�к���N�����������ӣ����������Һ��________ ��________��
(2)��֪ij����������Һ��Na����H2O�ĸ���֮��Ϊ1��a������������Һ��________Ϊ________��
��.�����£�10.0 mL 1.0 mol��L��1��H2SO4(aq)����ˮϡ�͵�500 mL������H2SO4(aq)��Ũ��Ϊ________mol��L��1������Ũ����ʹ��Һ�����Ϊ2.40 mL������H2SO4(aq)��Ũ��Ϊ________mol��L��1��
��.��֪��״����1���ˮ���ܽ�500������Ȼ��⣬��������״�����Ȼ��ⱥ����Һ�����ʵ���������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ظ�(Cr)����Һ����Ҫ��Cr3��������ɫ����Cr(OH)![]() ����ɫ����Cr2O72�����Ⱥ�ɫ����CrO42������ɫ������ʽ���ڡ�Cr(OH)3Ϊ������ˮ�Ļ���ɫ���塣�ش��������⣺
����ɫ����Cr2O72�����Ⱥ�ɫ����CrO42������ɫ������ʽ���ڡ�Cr(OH)3Ϊ������ˮ�Ļ���ɫ���塣�ش��������⣺
��1��Cr3����Al3���Ļ�ѧ�������ơ���Cr2(SO4)3��Һ����μ���NaOH��Һֱ���������ɹ۲쵽��������________________________��
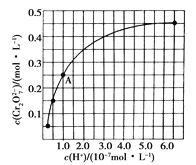
��2��CrO42����Cr2O72������Һ�п��ת���������³�ʼŨ��Ϊ1.0 mol��L��1��Na2CrO4��Һ��c(Cr2O72��)��c(H��)�ı仯����ͼ��ʾ��
�������ӷ���ʽ��ʾNa2CrO4��Һ�е�ת����Ӧ_____________________��
����ͼ��֪����Һ��������CrO42����ƽ��ת����________(��������������С������������)������A�����ݣ��������ת����Ӧ��ƽ�ⳣ��Ϊ___________��
�������¶ȣ���Һ��CrO42����ƽ��ת���ʼ�С����÷�Ӧ����H________0(������������С��������������)��
��3���ڻ�ѧ�����в���K2CrO4Ϊָʾ������AgNO3����Һ�ζ���Һ��Cl��������Ag����CrO42������ש��ɫ������ָʾ�ζ��յ�ĵ������Һ��Cl��ǡ�ó�����ȫ(Cl��Ũ�ȵ���1.0��10��5mol��L��1)ʱ����Һ��c(Ag��)Ϊ________mol��L��1����ʱ��Һ��c(CrO![]() )����________mol��L��1��(��֪Ag2CrO4��AgCl��Ksp�ֱ�Ϊ2.0��10��12��2.0��10��10)��
)����________mol��L��1��(��֪Ag2CrO4��AgCl��Ksp�ֱ�Ϊ2.0��10��12��2.0��10��10)��
��4����6�۸��Ļ����ﶾ�Խϴ���NaHSO3����Һ�е�Cr2O72����ԭ��Cr3�����÷�Ӧ�����ӷ���ʽΪ_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯��Ҫ���뻹ԭ������ʵ�ֵģ� ��
A.MnO2��Mn2+
B.CO��CO2
C.Cu��Cu2+
D.Cl2��Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
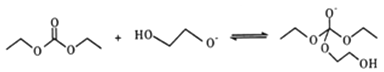
����Ŀ�����Ҷ���(PEG) ��һ����;�㷺�ľۺ��1,2-�Ҷ���̼����(�ֳ�Ϊ̼��������) ��һ��ҽҩ�м��塣ijС������A Ϊԭ�Ϻϳ�PEG��̼����������·�����������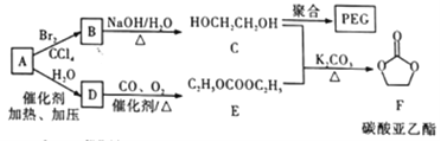
��֪: 2C2H5OH+CO+1/2O2 ![]() C2H5OCOOC2H5+H2O
C2H5OCOOC2H5+H2O
�ش�����������
��1��A������Ϊ____________�� A��B�ķ�Ӧ����Ϊ__________��C �ĺ˴Ź��������з������Ϊ___________��F�ķ���ʽΪ____________________��
��2��B��C�Ļ�ѧ����ʽΪ____________��
��3��C��һ�������·����ۺϷ�Ӧ����PEC����ѧ����ʽΪ___________________����ij��PEG��ƽ����Է�������Ϊ2000�� ����ƽ���ۺ϶�Ϊ____________________��
��4��E��ͬ���칹���У�������OCOO�����ŵĹ���___��(������E�������칹)��
��5��������ΪC��E����F�ķ�Ӧ���̿�������:
��HOCH2CH2OH + CO32-![]() HOCH2CH2O-+HCO3-
HOCH2CH2O-+HCO3-
��
��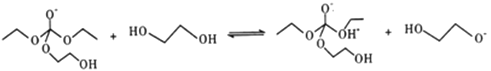
��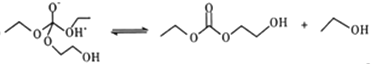
��
�ޢߢ��
��HOCH2CH2O- +HCO3-��HOCH2CH2OH+CO32-
д�������������ޢߢ��ķ�Ӧ����ʽ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��г��ˢ١������Ԫ�������ڱ��е�λ�ã�
��A | ��A | |||||||
1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | ||||
�밴Ҫ��ش��������⡣
(1)Ԫ�آܵ�������______��Ԫ�آ������ڱ�������λ��____________����Ԫ��ԭ�ӵ�ʧ���ӵĽǶȿ���Ԫ�آܾ���____________��(������ԡ�������ԭ�ԡ�)��
(2)����̬�⻯����ȶ���������ǿ��˳�����У��ޢܢߵ��⻯���ȶ���__________(д�⻯��Ļ�ѧʽ)��
(3)Ԫ�آߵ�ԭ�ӽṹʾ��ͼ��____________��
(4)д��Ԫ�آ��γɵĵ�����������ȼ�յĻ�ѧ����ʽ______________________����һ��Ӧ��____________(����ȡ��������ȡ�)��Ӧ��
(5)Ԫ�آ�����γɵĻ�������������ո�ʱ�������________ɫ��
(6)�õ���ʽ�ֱ��ʾ��ʾ����Ԫ�صĵ��ʷ�Ӧ�õ��Ļ�������γɹ��̣�
����ܣ�___________________________��
����ߣ�___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ñ�Ũ�ȵ�NaOH��Һ���ζ�δ֪Ũ�ȵ����ᣬ���в����л�ʹ����ⶨŨ�ȱ�ʵ��Ũ��ƫ�ߵ��ǣ�������
�ټ�ʽ�ζ���������ˮϴ����δ�ñ���Һ��ϴ������ƿ������������ˮ��ʵ��ʱû�к�ɴ�������ȡδ֪Ũ���������ʽ�ζ���������ˮϴ����δ�ô���������ϴ���ܵζ�ǰ��ʽ�ζ��ܼ������δ�ų����ζ���������ʧ���ݵζ������ʱ�����Ӷ�����
A. �٢� B. �ڢ� C. �٢� D. �ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾϸ����ijЩ�л����Ԫ����ɺ��ܹ�ϵ������A��B����Ԫ�أ������������ӣ� X��Y��Z��P�ֱ�Ϊ�����������ӵĻ�����λ����ش��������⣺
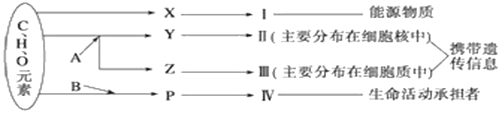
��1������С����������Ҫ��ָ______���������λX��______��
��2��A������Ԫ����____������____������RNA��Z��_____��
��3����һ�����е�Ԫ����______��P�Ľṹͨʽ��______��ͼ����P�γɢ��ķ�Ӧ��ʽ��Ϊ____�������ض����ܵķ�������_____�ṹ�йء���P��ƽ����Է�������r���ɶ��P�γ�m���������������۵��γ�����Է�������Ϊe�Ģ�������������ļ�����Ŀ��__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com