
【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ⅧA | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题。
(1)元素④的名称是______,元素④在周期表中所处位置____________,从元素原子得失电子的角度看,元素④具有____________性(填“氧化性”、“还原性”);
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性__________(写氢化物的化学式);
(3)元素⑦的原子结构示意图是____________;
(4)写出元素⑤形成的单质在氧气中燃烧的化学方程式______________________,这一反应是____________(填“吸热”、“放热”)反应;
(5)元素⑨与⑤形成的化合物高温下灼烧该时,火焰呈________色;
(6)用电子式分别表示表示下列元素的单质反应得到的化合物的形成过程:
①与④:___________________________;
⑤与⑦:___________________________。
【答案】氧第二周期第ⅥA族氧化性H2O>H2S>PH3 2Na+O2
2Na+O2![]() Na2O2放热黄色
Na2O2放热黄色![]()
![]()
【解析】
首先依据元素在周期表的相对位置判断出元素,然后结合元素周期律以及相关物质的性质分析解答。
根据①~⑨九种元素在周期表中的位置可知分别是H、C、N、O、Na、P、S、Ne、Cl。则
(1)元素④的名称是氧,在周期表中所处位置是第二周期第ⅥA族。氧元素最外层电子数是6个,容易得到电子,因此从元素原子得失电子的角度看,氧元素具有氧化性;
(2)非金属性越强,氢化物的稳定性越强,⑥④⑦非金属性强弱顺序是O>S>P,则氢化物稳定性为H2O>H2S>PH3;
(3)元素⑦是Cl,原子序数是17,其原子结构示意图是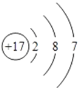 ;
;
(4)钠单质在氧气中燃烧生成过氧化钠,反应的化学方程式为2Na+O2![]() Na2O2,这一反应是放热反应;
Na2O2,这一反应是放热反应;
(5)元素⑨与⑤形成的化合物是氯化钠,高温下灼烧该时,火焰呈黄色;
(6)①与④形成的是水,含有共价键的共价化合物,其形成过程可表示为![]() ;⑤与⑦形成的是硫化钠,含有离子键的离子化合物,其形成过程可表示为
;⑤与⑦形成的是硫化钠,含有离子键的离子化合物,其形成过程可表示为![]() 。
。


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是

A. 在t℃时,AgBr的Ksp为4.9×10-13
B. 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C. 图中a点对应的是AgBr的不饱和溶液
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气细颗粒物吸附的水分中NO2与SO2的化学反应是当前雾霾期间硫酸盐的主要生成路径。某实验小组对雾霾的成分进行了验证,并测定空气中SO2的含量及探究H2SO3的部分性质。
回答下列问题:
(1)硫酸铵是某地PM2.5雾霾的主要成分,收集一定量的雾霾固体进行验证。
取一定量的雾霾固体于试管中,加入适量的水溶解,把溶液分成两份盛于试管中:
操作步骤 | 实验现象 | 结论 |
①向其中一份_______ | 有白色沉淀生成 | 证明雾霾固体中含有SO42- |
②向另一份中_____,用镊子夹持湿润的红色石蕊试纸靠近试管口 | ③试管中有气泡产生,___________________ | 证明雾霾固体中含有NH4+。综合上面实验,初步说明雾霾固休颗粒中含有(NH4)2SO4 |
(2)用如图所示简易装置测定空气中SO2的含量。
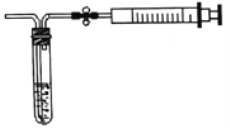
①测定原理:SO2通入碘的淀粉溶液中,使溶液由蓝色变为无色,反应的化学方程式为______。
②测定方法:在某监测点,量取5.0mL5.0×10-4mol/L的碘溶液,注入图中的试管中,加2-3滴淀粉指示剂,此时溶液呈蓝色,按图中装置连接好仪器,利用止水夹控制,进行抽气,取下注射器排气,重复操作直到溶液的蓝色全部褪尽为止,共抽取空气8000.0mL,则测得该监测点空气中SO2的含量为_____mg/L。
(3)探究H2SO3的部分性质。
选用下面的装置和药品探究H2SO3与HClO的酸性强弱
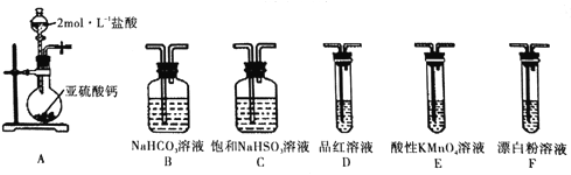
①甲同学认为按照A→C→F→尾气处理的顺序连接装置,可以证明H2SO3与HClO的酸性强弱,乙同学认为该方案不合理,其理由是_________________。
②丙同学采用间接法证明,实验方案为:按照A→C____(其字母) →尾气处理顺序连接装置,其中装置C的作用是___________;证明H2SO3的酸性强于HClO的酸性的实验现象是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所给的信息和标志,判断下列说法正确的是
A | B | C | D |
《本草纲目拾遗》中述“铁线粉”:“粤中洋行有舶上铁丝,……日久起销,用刀刮其销,.....,所刮下之销末,名铁线粉” | 《本草纲目》:“(火药)乃焰消(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者” | 可燃冰 |
|
“铁线粉”是Fe3O4 | 利用KNO3的氧化性 | “可燃冰”是可以燃烧的水 | “绿色食品”是指绿色的食品 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg===Cu2HgI4+2Cu(反应前后的I均为-1价且产物中的汞元素为+2价)。
(1)上述反应产物Cu2HgI4中,铜元素显______价。
(2)以上反应中的氧化剂为________,还原剂为________,氧化产物是________,还原产物是________,当有2 mol CuI参与反应时,转移电子________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用移液管(或碱式滴定管)量取25.00 mL 烧碱溶液于锥形瓶中并加几滴酚酞指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
请完成下列问题:
(1)正确的操作步骤是(填写字母) ____→____→____→D→____。
(2)操作D中液面应调整到_______________;尖嘴部分应________________。
(3)以下操作会造成所测烧碱溶液浓度偏低的是(____)
A.酸式滴定管未用待装溶液润洗 B.碱式滴定管未用待装溶液润洗
C.锥形瓶未用待装溶液润洗 D.在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(4)该烧碱样品的纯度计算式是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-物质结构与性质】许多过渡元素(如锰、钒、铬、铁、铜等)的化合物对化学反应具有良好的催化性。回答下列问题:
(1)基态铬原子的价层电子排布式为_________;Mn2+的稳定性强于Mn3+,其原因是_______。
(2)已知常温下,H2CrO4的K1=4.1、K2=1×10-5,从结构的角度上看,K2<<K1的原因是_________。已知Cr2(SO4)3的熔点为100℃、沸点为330℃,则Cr2(SO4)3晶体中微粒间的相互作用力是__________。
(3)SO2与氧气在V2O5催化作用下反应可转化为SO3,则转化过程中_____(填字母)没有发生变化。
a.中心原子轨道杂化类型 b.键角 c.分子的极性
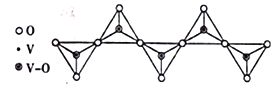
(4)+5价钒能形成多种含氧酸根盐,其中某种钠盐的酸根离子是一种具有无限链状结构的离子(见下图),则该酸根离子的化学式为__________。
(5)CuSO4溶液中Cu2+是以[Cu(H2O)4]2+形式存在的,向CuSO4溶液中加入过量氨水后会得到[Cu(NH3)4]2+,则上述两种配离子中稳定性较强的是_________,N、O、S、Cu四种元素的第一电离能由大到小的顺序为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com