
����Ŀ������ѧ-���ʽṹ�����ʡ��������Ԫ��(���̡�������������ͭ��)�Ļ�����Ի�ѧ��Ӧ�������õĴ��ԡ��ش���������:
(1)��̬��ԭ�ӵļ۲�����Ų�ʽΪ_________��Mn2+���ȶ���ǿ��Mn3+����ԭ����_______��
(2)��֪������,H2CrO4��K1=4.1��K2=1��10-5���ӽṹ�ĽǶ��Ͽ���K2<<K1��ԭ����_________����֪Cr2(SO4)3���۵�Ϊ100�桢�е�Ϊ330�棬��Cr2(SO4)3��������������������__________��
(3)SO2��������V2O5�������·�Ӧ��ת��ΪSO3,��ת��������_____(����ĸ)û�з����仯��
a.����ԭ�ӹ���ӻ����� b.���� c.���ӵļ���
(4)+5�۷����γɶ��ֺ�������Σ�����ij�����ε����������һ�־���������״�ṹ������(����ͼ)�����������ӵĻ�ѧʽΪ__________��
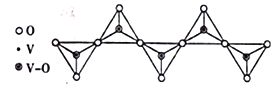
(5)CuSO4��Һ��Cu2+����[Cu(H2O)4]2+��ʽ���ڵģ���CuSO4��Һ�м��������ˮ���õ�[Cu(NH3)4]2+���������������������ȶ��Խ�ǿ����_________��N��O��S��Cu����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ__________��
���𰸡� 3d54s1 Mn2+��3d�ܼ�Ϊ�����״̬��Mn3+���� �ڶ�����������Ķ�������������½��H+������ǿ�ڵ�һ�����������һ��������ӽ��H+������ ���»��� a (VO3)nn- (��VO3-) [Cu(NH3)4]2+ N>O>S>Cu
����������1��CrΪ37��Ԫ�أ����̬���۵����Ų�ʽΪ1s22s22p63s23p63s23p63d54s1�����Ի�̬��ԭ�ӵļ۵����Ų�ʽ��3d54s1��MnΪ25��Ԫ�أ�Mn�ļ۵����Ų�ʽΪ��3d54s2��Mn2+�ļ۲�����Ų�ʽΪ3d5��Mn3+�ļ۲�����Ų�ʽΪ3d4��Mn2+��3d�ܼ�Ϊ�����״̬��Mn3+���ǣ���Mn2+���ȶ���ǿ��Mn3+���ʴ�Ϊ��3d54s1��Mn2+��3d�ܼ�Ϊ�����״̬��Mn3+������
��2���ڶ�����������Ķ�������������½��H+������ǿ�ڵ�һ�����������һ��������ӽ��H+������������H2CrO4��K2<1��
��3��a��SO2�ļ۲���ӶԸ���=2+![]() =3��������ԭ�Ӳ�ȡsp2�ӻ���SO3�м۲���ӶԸ���=3+
=3��������ԭ�Ӳ�ȡsp2�ӻ���SO3�м۲���ӶԸ���=3+![]() =3����ԭ�Ӳ�ȡsp2�ӻ�����a��ȷ��b��SO2����ΪV�νṹ����1�Թ¶Ե��ӣ�������Ϊ119.5����SO3����Ϊƽ���������νṹ��û�й¶Ե��ӣ�����Ϊ120�㣬��b����c��SO2���ӽṹ�Գƣ��ǷǼ��Է��ӣ�SO3���Գƣ��Ǽ��Է��ӣ���c����ѡa��
=3����ԭ�Ӳ�ȡsp2�ӻ�����a��ȷ��b��SO2����ΪV�νṹ����1�Թ¶Ե��ӣ�������Ϊ119.5����SO3����Ϊƽ���������νṹ��û�й¶Ե��ӣ�����Ϊ120�㣬��b����c��SO2���ӽṹ�Գƣ��ǷǼ��Է��ӣ�SO3���Գƣ��Ǽ��Է��ӣ���c����ѡa��
��4������״�ṹ��֪��ÿ��V��3��O�γ������ӣ���V�Ļ��ϼ�Ϊ+5�ۣ����������ӵĻ�ѧʽΪ(VO3)nn- (��VO3-)���ʴ�Ϊ��(VO3)nn- (��VO3-)��
��5��[Cu(H2O)4]2+ת��Ϊ[Cu(NH3)4]2+����Nԭ�ӵ���λ������Oԭ�ӵ���λ����ǿ����[Cu(NH3)4]2+���ȶ���CuΪ����Ԫ�أ���һ���������N��OԪ�ش��ڵڶ����ڣ���NԪ��2p�ܼ����ڰ�����ȶ�״̬�������ͣ�����NԪ�صĵ�һ�����ܸ���ͬ��������Ԫ�ص�һ�����ܣ���N��O��ͬ����Ԫ�أ����ŵ��Ӳ�����࣬��һ��������С�����һ������O��S���ʵ�һ�����ܴ�С˳��ΪN��O��S��Cu���ʴ�Ϊ��[Cu(NH3)4]2+��N��O��S��Cu��


 ���ٴ�����ɽ����ϵ�д�
���ٴ�����ɽ����ϵ�д� ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��г��ˢ١������Ԫ�������ڱ��е�λ�ã�
��A | ��A | |||||||
1 | �� | ��A | ��A | ��A | ��A | ��A | ��A | |
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� | ||||
�밴Ҫ��ش��������⡣
(1)Ԫ�آܵ�������______��Ԫ�آ������ڱ�������λ��____________����Ԫ��ԭ�ӵ�ʧ���ӵĽǶȿ���Ԫ�آܾ���____________��(������ԡ�������ԭ�ԡ�)��
(2)����̬�⻯����ȶ���������ǿ��˳�����У��ޢܢߵ��⻯���ȶ���__________(д�⻯��Ļ�ѧʽ)��
(3)Ԫ�آߵ�ԭ�ӽṹʾ��ͼ��____________��
(4)д��Ԫ�آ��γɵĵ�����������ȼ�յĻ�ѧ����ʽ______________________����һ��Ӧ��____________(����ȡ��������ȡ�)��Ӧ��
(5)Ԫ�آ�����γɵĻ�������������ո�ʱ�������________ɫ��
(6)�õ���ʽ�ֱ��ʾ��ʾ����Ԫ�صĵ��ʷ�Ӧ�õ��Ļ�������γɹ��̣�
����ܣ�___________________________��
����ߣ�___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͬ���ʵ�����SO2��SO3 �� ����˵������ȷ���ǣ� ��
A.��Ԫ�ص�������Ϊ5��4
B.�κ����������Ⱦ�Ϊ1��1
C.���е�O2��O3��������֮��Ϊ1��1
D.SO2��SO3��������֮��Ϊ1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾϸ����ijЩ�л����Ԫ����ɺ��ܹ�ϵ������A��B����Ԫ�أ������������ӣ� X��Y��Z��P�ֱ�Ϊ�����������ӵĻ�����λ����ش��������⣺
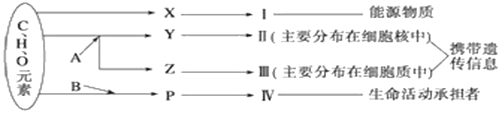
��1������С����������Ҫ��ָ______���������λX��______��
��2��A������Ԫ����____������____������RNA��Z��_____��
��3����һ�����е�Ԫ����______��P�Ľṹͨʽ��______��ͼ����P�γɢ��ķ�Ӧ��ʽ��Ϊ____�������ض����ܵķ�������_____�ṹ�йء���P��ƽ����Է�������r���ɶ��P�γ�m���������������۵��γ�����Է�������Ϊe�Ģ�������������ļ�����Ŀ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����
��һ��ʵ��������һƿ����һ�������ʵ��ռ���Ʒ��ijѧ�����к͵ζ����ⶨ�ռ�Ĵ��ȣ����ռ����������������Ӧ�������ʵ��ش�
��1����ȷ��ȡ��5g�ռ���Ʒ���100 mL����Һ����Ҫ����Ҫ��������Ͳ���ձ�����������������ƽ�⣬�������õ��IJ��������У�____________��_____________��
��2��ȡ10.00 mL����Һ��ѡ����ͼ��_________����A��B������ȡ��

��3����0.5000mol/L������ζ������ռ���Һ���Է�̪Ϊָʾ�����ζ�ʱ������ת�ζ��ܲ������������ֲ�ͣ��ҡ����ƿ������ע��___________��ֱ���ζ��յ㡣�ζ��ﵽ�յ�ı�־�ǣ�_________��
��4�������������ݣ��ռ�Ĵ���Ϊ��_______________________������=�����ʵ�����/��Ʒ��������100����
�ζ����� | ����Һ�����mL�� | �����������mL�� | |
�ζ�ǰ���� | �ζ������ | ||
��һ�� | 10.00 | 0.50 | 20.40 |
�ڶ��� | 10.00 | 4.00 | 24.10 |
������������ԭ�ζ�ʵ��������к͵ζ����ƣ�����֪Ũ�ȵ���������Һ�ζ�δ֪Ũ�ȵĻ�ԭ����Һ��֮������Ѫ�Ƶĺ���ʱ����������ʵ�飺
�ٿɽ�2mLѪҺ������ˮϡ�ͺ������м�����������泥�NH4��2C2O4���壬��Ӧ���� CaC2O4��������������ϡ���ᴦ����H2C2O4��Һ��
�ڽ��ٵõ���H2C2O4��Һ����������KMnO4��Һ�ζ�����������ΪCO2����ԭ����ΪMn2+��
���յ�ʱ��ȥ20mL l.0��l0��4 mol/L��KMnO4��Һ��
��1��д����KMnO4�ζ�H2C2O4�����ӷ���ʽ_____________________��
��2���ζ�ʱ����KMnO4��Һװ��________��������ʽ��������ʽ�����ζ����С�
��3�����㣺ѪҺ�к������ӵ�Ũ��Ϊ_____mol��L-1��
���𰸡� ��ͷ�ι� 100mL����ƿ A ��ƿ����ɫ�ı仯 ���һ������ν���ƿ�ں�ɫ��ȥ��30s����ԭ 80% 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2��+8H2O ��ʽ 2.5��10-3
����������һ����1������һ��Ũ�ȵ���Һ����Ҫ�õ�100mL������ƿ������Ҫ��ͷ�ιܶ��ݡ�
��2�����������������ҺӦ��ʹ�ü�ʽ�ζ��ܣ�ѡ��A��
��3���ζ�ʱ�۾�Ӧ��ע����ƿ��Һ����ɫ�ı仯���ﵽ�յ�ʱҪ��ʱֹͣ�ζ����ζ��յ������Ϊ����Һ��ɫ��ȥ��30s����ԭ�����Դ�Ϊ�����һ������ν���ƿ�ں�ɫ��ȥ��30s����ԭ��
��4�����εζ���������������ֱ�Ϊ19.90mL��20.10mL������ƽ��Ϊ20.00mL������HCl�����ʵ���Ϊ20��0.5��1000=0.01mol��������������Ϊ0.01mol����Ϊ����100mL��Һȡ��10mL���еĵζ�������ԭ������������Ϊ0.1mol������Ϊ4g����������Ϊ4��5=80%��
��������1��KMnO4�ζ�H2C2O4�ķ���ʽΪ��2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2�� + 8H2O����Ӧ�����ӷ���ʽΪ��2MnO4-+ 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2
��2��������ؾ���ǿ�����ԣ���������ʽ�ζ����¶˵��ܣ�����ֻ������ʽ�ζ���ʢ�š�
��3�����ݷ�Ӧ���������̣��õ����µĹ�ϵʽCa2+��CaC2O4��H2C2O4��2/5 KMnO4������Ca2+��KMnO4��5/2�����������Ϊ20��1��10-4��1000=2��10-6mol������Ca2+Ϊ5��10-6mol������Ũ��Ϊ5��10-6��0.002��2.5��10-3mol/L��
�����͡�ʵ����
��������
20
����Ŀ�����ᡢ�����̼���ǻ�ѧʵ����о��г��õļ����ᡣ
��֪�����£�Ka��CH3COOH����1.7��10��5 mol�� L��1��
H2CO3�ĵ��볣��Ka1��4.2��10��7mol��L��1��Ka2��5.6��10��11mol��L��1��
��1�����������ӷ���ʽ����̼������ˮ��Һ�Լ��Ե�ԭ��________________��
�ڳ����£����ʵ���Ũ����ͬ������������Һ��a��̼������Һ b����������Һ c������������Һ d��̼��������Һ����pH�ɴ�С��˳���ǣ�___________������ţ���
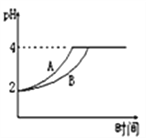
��2�������£�ȡ pH=2������ʹ�����Һ��100mL�������зֱ����������Zn������Ӧ����������Һ��pH�仯����ͼ��ʾ�����ʾ������ҺpH�仯��������___ ������A������B�������������м����Zn����Ϊm1��������Һ�м����Zn����Ϊ m2���� m1 ___ m2 �� ѡ����<������=������>������
��3��ij�¶��£�pH��Ϊ4������ʹ�����Һ�ֱ��ˮϡ�ͣ���pH����Һ����仯������ͼ���£�����a��b��c�����Ӧ����Һ��ˮ�ĵ���̶��ɴ�С��˳����_______���ô�����Һϡ�����У����и���һ����С����______________��
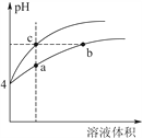
a��c(H��) b��c(OH��)
c�� ![]() d��
d�� 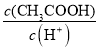
��4����Cr2O72-�ķ�ˮ���Խϴ�ij������ˮ�к�5.0��10-3mol/L��Cr2O72-��Ϊ��ʹ��ˮ���ŷŴ�꣬�������´�����
![]()
��������������ķ�ˮ��c(Cr3+)=6.0��10-7mol/L��������ķ�ˮ�� pH=___________��{Ksp[Cr(OH)3]=6.0��10-31}
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ص�ԭ�Ӻ������ĸ����Ӳ㣬��3d�ܼ��ϵĵ�������4s�ܼ��ϵ�3�������Ԫ����(����)
A. S B. Fe C. Si D. Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڿ��淴Ӧ�У��ı���������һ���ܼӿ췴Ӧ���ʵ���
A.����B.����ѹǿC.����Ӧ�����D.�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݽ�ף�����ϲ������Ư��մ�������ϣ�����ҧס����ʹ���ݱ�ý�ס�������������ˮ��������Һ����Ϊ����Ư������
A��Cl2 B��HNO3 C��Na2O2 D��H2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ����˵������ȷ���ǣ� ��
A.������۲�����
B.������ͨ����Ĥ
C.����������ͣ���������˶�
D.���岻�ȶ������ú����ײ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com