
(7分)
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有 和 。
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
时间/min | 1 | 2 | 3 | 4 | 5 |
体积/mL | 50 | 120 | 232 | 290 | 310 |
①哪一时间段反应速率最大_______(填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为________。
③试分析1~3min时间段里,反应速率变大的主要原因 。
(3)对于容积固定的反应:N2(g)+3H2(g)  2NH3(g)(正反应放热),达到平衡的标志有___ 。
2NH3(g)(正反应放热),达到平衡的标志有___ 。
A N2、H2、NH3的百分含量不再变化 B 总压强不变
C N2、H2、NH3的分子数之比为1∶3∶2 D N2、H2、NH3的浓度相等
E.N2、H2不再起反应 F.v(N2)=v(H2)
G.混合气体的密度不变 H.混合气体的平均相对分子质量不变
I.正反应放出的热量等于逆反应吸收的热量
(1)温度、浓度;(2)①“2~3 min”② 0.1 mol/(L·min),③反应放热成为影响速率的主要因素;(3)ABHI
【解析】
试题分析:(1)根据题意知,当加热或加入浓盐酸后,反应速率明显加快,说明温度升高、浓度增大,可增大反应速率,则影响化学反应速率的因素有温度和浓度;(2)①2~3min收集的气体的体积比其它时间段体积大,说明该时间段反应速率最大;②2~3min时间段生成氢气体积为232ml-120mL=112mL,n(H2)=0.005mol,则消耗n(HCl)=0.01mol,v(HCl)=0.1mol.L-1.min-1;③开始反应时浓度逐渐变小,温度逐渐升高,但反应速率逐渐增大,说明反应放热成为影响速率的主要因素。(3)对于容积固定的反应:N2(g)+3H2(g)  2NH3(g)(正反应放热),A.N2、H2、NH3的百分含量不再变化,已达平衡,正确;B.根据阿伏加德罗定律,总压强不变,容器内气体的总物质的量不变,该反应反应前后气体的物质的量不等,说明已达平衡状态,正确;C.N2、H2、NH3的分子数之比为1∶3∶2,不一定处于平衡状态,错误;D.N2、H2、NH3的浓度相等,不一定处于平衡状态,错误; E.化学平衡为动态平衡,N2、H2不再起反应,错误;F.v(N2)=v(H2),没有明确正逆反应速率,错误; G.混合气体的密度不随反应的进行而变化,密度不变不能说明已达平衡状态,错误;H.混合气体的平均相对分子质量不变,已达平衡状态,正确;I.正反应放出的热量等于逆反应吸收的热量,说明正逆反应速率相等,已达平衡状态,正确,选ABHI。
2NH3(g)(正反应放热),A.N2、H2、NH3的百分含量不再变化,已达平衡,正确;B.根据阿伏加德罗定律,总压强不变,容器内气体的总物质的量不变,该反应反应前后气体的物质的量不等,说明已达平衡状态,正确;C.N2、H2、NH3的分子数之比为1∶3∶2,不一定处于平衡状态,错误;D.N2、H2、NH3的浓度相等,不一定处于平衡状态,错误; E.化学平衡为动态平衡,N2、H2不再起反应,错误;F.v(N2)=v(H2),没有明确正逆反应速率,错误; G.混合气体的密度不随反应的进行而变化,密度不变不能说明已达平衡状态,错误;H.混合气体的平均相对分子质量不变,已达平衡状态,正确;I.正反应放出的热量等于逆反应吸收的热量,说明正逆反应速率相等,已达平衡状态,正确,选ABHI。
考点:考查化学反应速率、化学平衡状态的判断。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014江西省盟校高三第二次联考理综化学试卷(解析版) 题型:选择题
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系,下列说法正确的是( )

A.a点对应的溶液和c点对应的溶液pH值大小:
pH(c)>pH(a)
B.d点对应的溶液中大量存在:K+、Ba2+、NO3-、I-
C.25℃时,Ka(HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,
0.1mol/L的NaF溶液与0.1mol/L 的CH3COOK溶液相比:
c(Na+)-c(F-)>c(K+)-c(CH3COO-)
D.如b点对应的溶液中只含NaHA,则溶液中粒子浓度大小:
c(HA-)>c(H2A)>c(H+)>c(A2-)
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省宜春市高三模拟考试理综化学试卷(解析版) 题型:选择题
中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途,其生产过程的部分流程如图所示
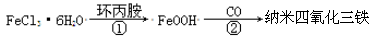
下列有关叙述不合理的是 ( )
A.纳米四氧化三铁可分散在水中,它与FeCl3溶液的分散质直径相当
B.纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病
C.在反应①中环丙胺的作用可能是促进氯化铁水解
D.反应②的化学方程式是6FeOOH +CO 2Fe3O4+3H2O+CO
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省南昌市高二下学期期末考试化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/L
B.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L
C.配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾
D.中和100 mL 1 mol/L的H2SO4溶液,需NaOH 4 g
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省南昌市高一文理分科测试化学试卷(解析版) 题型:简答题
(6分)某链烃3.6g和Cl2发生取代反应,控制反应条件使其仅生成一氯代物,将反应生成的气体(一氯代物为液体)用NaOH溶液吸收恰好和0.1mol·L-1 NaOH溶液500mL完全反应,试解答下列问题:
(1)求该烃的相对分子质量;
(2)若该烃既不能使酸性KMnO4溶液褪色,又不能使溴水褪色,试求该烃的分子式。
(3)若该烃的一氯代物只有一种,试确定该烃的结构简式 (要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省南昌市高一文理分科测试化学试卷(解析版) 题型:选择题
氢氧燃料电池是一种新能源。下图为氢氧燃料电池示意图。下列说法不正确的是

A.电子由B极通过导线流向A极
B.A极是负极,B极是正极
C.该装置能将化学能转化为电能
D.产物为无污染的水,属于环境友好电池
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省南昌市高一文理分科测试化学试卷(解析版) 题型:选择题
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
| X | Y | Z |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | KOH溶液 | SiO2 | 浓盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高二下学期期末考试化学试卷(解析版) 题型:选择题
NA代表阿伏伽德罗常数。已知C2H4和C3H6的混合物的质量为ag,则该混合物
A.所含共用电子对数目为(a/7+1)NA B.所含碳氢键数目为aNA/7
C.燃烧时消耗的O2一定是 33. 6a/ 14L D.所含原子总数为aNA/14
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高一下学期期末考试化学试卷(解析版) 题型:选择题
除去括号内杂质所用试剂和方法,正确的是
A.乙醇(乙酸)、 KOH溶液 、 分液
B.乙烯(SO2) 、 KMnO4溶液 、 洗气
C.乙烷(乙烯)、 H2(催化剂)、 催化加氢
D.乙醇(水)、 CaO 、 蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com