
【题目】决定物质性质的重要因素是物质结构.请回答下列问题. 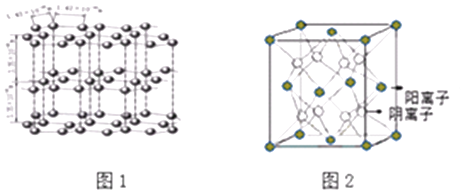
(1)如图1是石墨的结构,其晶体中存在的作用力有(填序号)
A:σ键 B:π键 C:氢键 D:配位键
E:分子间作用力 F:金属键 G:离子键
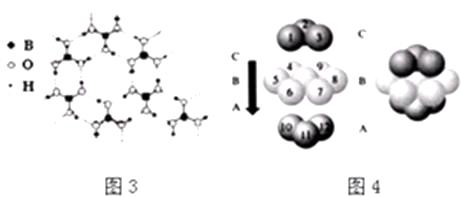
(2)CaF2结构如图2所示,Cu形成晶体的结构如4所示,3为H3BO3晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)
图2所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为 ,
图4中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为;铜在周期表中的位置 .
科目:高中化学 来源: 题型:
【题目】根据所学知识填空。
(1)用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.Fe还原水体中NO3﹣的反应原理如图所示. 
①作负极的物质是 .
②正极的电极反应式是 .
(2)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)CH3OH(g)△H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)CO(g)+H2O(g)△H3
已知反应①中相关的化学键键能数据如表:
化学键 | H﹣H | C﹣O | C﹣O | H﹣O | C﹣H |
E/(KJmol﹣1) | 436 | 343 | 1075 | 465 | 413 |
由此计算△H1=kJmol﹣1 . 已知△H2=﹣58kJmol﹣1 , 则△H3=kJmol﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣的一种或几种,取该溶液进行实验,实验内容如下: 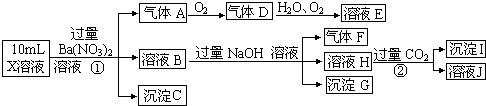
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是;
(2)写出有关离子方程式:步骤①中生成A;步骤②生成沉淀I;
(3)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,而沉淀C物质的量0.07mol,能说明(1)中不能确定的阴离子存在的理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.SO2 , CO2 , SiO2中的S,C,Si均为sp3杂化
B.SO32﹣ , CO32﹣ , SiO32﹣均为平面三角形
C.H3O+ , NH4+ , [Cu(NH3)4]2+均含有配位键
D.石墨、新型高分子导电材料聚乙炔、金属晶体均含有金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是
A. 氢气的燃烧热为-285.5 kJ/mol,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g) ΔH=+285.5 kJ/mol
B. lmol甲烷完全燃烧生成CO2和H2O(l)时放出890kJ热量,它的热化学方程式为: ![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g) H2O(l) △H= -445 kJ/mol
CO2(g) H2O(l) △H= -445 kJ/mol
C. 已知C(石墨,s)![]() C(金刚石,s) ΔH=+1.9kJ/mol,则金刚石比石墨稳定
C(金刚石,s) ΔH=+1.9kJ/mol,则金刚石比石墨稳定
D. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为: N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ/mol
2NH3(g) ΔH=-38.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制硫酸的一步重要的反应是SO2在400-500℃下催化氧化反应: 2SO2+O2![]() 2SO3,该反应是个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中不正确的是
2SO3,该反应是个正反应放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中不正确的是
A. 使用催化剂的目的是加快反应速率,提高生产效率
B. 在上述条件下,SO2不可能100%地转化为SO3
C. 增加O2的浓度,可以提高SO2的转化率
D. 当SO2和SO3的浓度相等时,反应一定达到平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com