
【题目】某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣的一种或几种,取该溶液进行实验,实验内容如下: 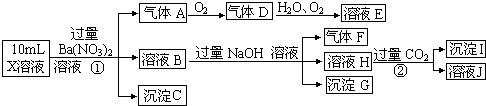
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是;
(2)写出有关离子方程式:步骤①中生成A;步骤②生成沉淀I;
(3)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,而沉淀C物质的量0.07mol,能说明(1)中不能确定的阴离子存在的理由是 .
【答案】
(1)Al3+、NH4+、Fe2+、SO42﹣
(2)3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O;AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣
(3)若检验Fe3+肯定存在时,就有Cl﹣存在,因肯定存在的离子电荷总数已相等
【解析】解:在强酸性溶液中一定不会存在CO32﹣和SO32﹣离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42﹣离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2 , E为HNO3 , 说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3 , 说明溶液中含有NH4+离子,沉淀G为Fe(OH)3 , 溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3 , H为NaAlO2 , 说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3﹣离子,含有SO42﹣离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl﹣ ,
(1.)由以上分析可知一定含有Al3+、NH4+、Fe2+、SO42﹣ ,
故答案为:Al3+、NH4+、Fe2+、SO42﹣;
(2.)①Fe2+离子被氧化为Fe3+离子,反应的离子方程式为3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O,②H为NaOH和NaAlO2混合物,通入过量二氧化碳后生成氢氧化铝的方程式为AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣ , 故答案为:3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O;AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣;
(3.)A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O,可知Fe2+物质的量为0.03mol; 碳溶液中正电荷为:2n(Fe2+)+3n(Al3+)+n(NH4+)+n(H+)=2×0.03mol+3×0.01mol+0.01mol+0.04mol=0.14mol;沉淀C为硫酸钡,其物质的量0.07mol,n(SO42﹣)=0.07mol,硫酸根离子所带的负电荷为:0.07mol×2=0.14mol,说明溶液中正负电荷相等,所以若检验Fe3+肯定存在时,就有Cl﹣存在,因肯定存在的离子电荷总数已相等,故答案为:若检验Fe3+肯定存在时,就有Cl﹣存在,因肯定存在的离子电荷总数已相等.
在强酸性溶液中一定不会存在CO32﹣和SO32﹣离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42﹣离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2 , E为HNO3 , 说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3 , 说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3 , H为NaAlO2 , 说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3﹣离子,含有SO42﹣离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl﹣ , 以此来解答.


科目:高中化学 来源: 题型:
【题目】磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得。室温下,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示。
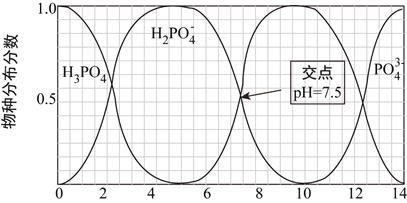
下列说法中正确的是( )
A. 电离方程式:H3PO4=3H++PO43-
B. pH=7时存在c(Na+)=c(H2PO4-)+c(HPO42-)
C. 向Na3PO4溶液中加入NaH2PO4溶液,不会发生化学反应
D. 相同温度和浓度下,H2PO4-的电离能力弱于HPO42-的水解能力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知: 氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。
I.制备氢化锂
选择图I中的装置制备氢化锂(有些装置可重复使用):
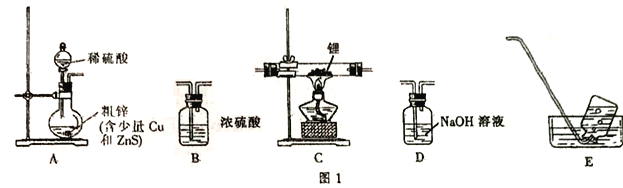
(1)装置的连接顺序(从左至右)为A→______________。
(2)检在好装蹬装置的气密性,点燃酒精灯前需进行的实验操作是_______________。
(3)写出制备氢化铝锂的化学方程式:__________________。
II. 制备氢化铝锂
1947年,Schlesinger,Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅样,充分反应后,经一系列操作得到LiAlH4晶体。
(4)写出氢化锂与无水三氯化铝反应的化学方程式:____________________。
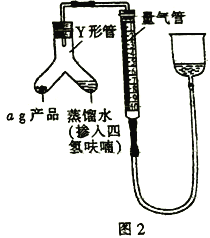
III.测定氢化铝锂产品(不含氢化锂)的纯度
(5)按图2装配仪器、检查装置气密性并装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是________。读数之前上下移动量气管右侧的容器,使量气管左、右有两侧的液面在同一水平面上,其目的是_________。
(6)在标准状况下,反应前量气管读数为V1mL,反应完毕并冷却之后,量气管读数为V2mL。该样品的纯度为_____________(用含a、V1、V2的代数式表示)。如果起始读数时俯视刻度线,测得的结果将________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.水的电离方程式:H2O=H++OH﹣
B.pH=7的溶液一定是中性溶液
C.升高温度,水的电离程度增大
D.将稀醋酸加水稀释时,c(H+)减小,c(OH﹣)也减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组利用以下装置制备氨气、氯气以及LiH固体. 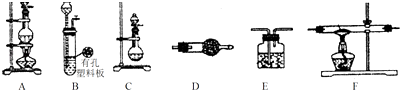
(1)为制备干燥的氨气,可将装置C与(填装置编号)连接;装置C中的烧瓶内加入的固体宜选用;(填选项字母)
a.生石灰 b.氯化钙 c.五氧化二磷
(2)连接装置A、E、E可制取纯净、干燥的氯气,则两个E装置内的药品依次;装置A中发生反应的离子方程式为;
(3)该小组准备利用上述部分装置制备LiH固体.可选用的药品有:金属锂、锌粒、稀盐酸、浓硫酸、碱石灰.已知:氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能引起燃烧.设计实验方案如下:
①仪器装置连接顺序为B→D→F→E,加入药品前首先要进行的实验操作是(不必写出具体的操作方法);加入药品后,其中装置D的作用是 .
②加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处.采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险.完成LiH与水反应的化学方程;
③准确称量制得的产品0.11g,在一定条件下与足量水反应后,共收集到气体291.2mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试回答下列各题:
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ______________________________。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1
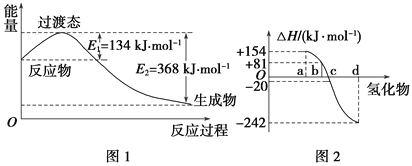
请填空:
共价键 | H—H | Cl—Cl | H—Cl |
键能/(kJ·mol-1) | 436 | 247 | ________ |
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式: ___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构.请回答下列问题. 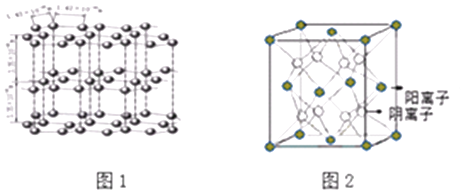
(1)如图1是石墨的结构,其晶体中存在的作用力有(填序号)
A:σ键 B:π键 C:氢键 D:配位键
E:分子间作用力 F:金属键 G:离子键
(2)CaF2结构如图2所示,Cu形成晶体的结构如4所示,3为H3BO3晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)
图2所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为 ,
图4中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为;铜在周期表中的位置 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】聚酰亚胺是重要的特种工程材料,已广泛应用在航空、航天、纳米、液晶、激光等领域。某聚酰亚胺的合成路线如图(部分反应条件略去)。
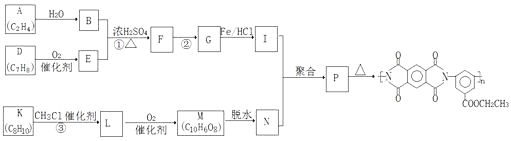
已知:
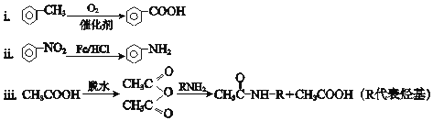
(1)A所含官能团的名称是 _________________________________。
(2)①反应的化学方程式是 _________________________________。
(3)②反应的反应类型是 ___________________________________。
(4)I的分子式为C9H12O2N2,I的结构简式是 ________________ 。
(5)K是D的同系物,核磁共振氢谱显示其有4组峰,与CH3Cl发生反应③的化学方程式是 ________________。
(6)1molM与足量的NaHCO3溶液反应生成4molCO2,M的结构简式是 ___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
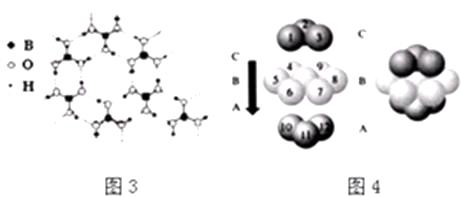
【题目】乙醇分子中不同化学键如图所示,关于乙醇在各种反应中断裂的键不正确的是( ) 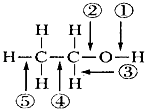
A.在Cu催化作用下和O2反应时键①⑤断裂
B.和氢溴酸共热时键②断裂
C.和金属钠反应时键①断裂
D.和浓硫酸加热到170℃,键②⑤断裂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com