
【题目】某化学小组利用以下装置制备氨气、氯气以及LiH固体. 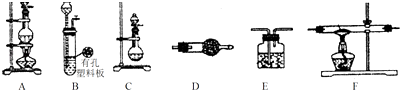
(1)为制备干燥的氨气,可将装置C与(填装置编号)连接;装置C中的烧瓶内加入的固体宜选用;(填选项字母)
a.生石灰 b.氯化钙 c.五氧化二磷
(2)连接装置A、E、E可制取纯净、干燥的氯气,则两个E装置内的药品依次;装置A中发生反应的离子方程式为;
(3)该小组准备利用上述部分装置制备LiH固体.可选用的药品有:金属锂、锌粒、稀盐酸、浓硫酸、碱石灰.已知:氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能引起燃烧.设计实验方案如下:
①仪器装置连接顺序为B→D→F→E,加入药品前首先要进行的实验操作是(不必写出具体的操作方法);加入药品后,其中装置D的作用是 .
②加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处.采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险.完成LiH与水反应的化学方程;
③准确称量制得的产品0.11g,在一定条件下与足量水反应后,共收集到气体291.2mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为 .
【答案】
(1)D;a
(2)饱和食盐水、浓硫酸;2Cl﹣+MnO2+4H+ ![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(3)检验装置的气密性;除去H2中的H2O和HCl;LiH+H2O=LiOH+H2↑;6:1
【解析】解:(1.)C装置是不需要加热制备氨气的装置,利用浓氨水滴入生石灰产生氨气,浓氨水中存在平衡:NH4++OH﹣NH3H2O NH3+H2O,加热或者加热碱性物质能够促进平衡正向移动,有利于氨气的挥发,而生石灰与水反应生成氢氧化钙,同时放出大量的热;氢氧化钠溶于水放出大量的热,氢氧化钙、氢氧化钠溶于水电离产生氢氧根离子,促进平衡向正方向移动,有利于氨气的挥发,所以为制备干燥的氨气,可将装置C(分液漏斗中放浓氨水,圆底烧瓶中放生石灰)与D(用碱石灰干燥氨气)连接,制备干燥的氨气,所以答案是:D;a;
(2.)二氧化锰在加热条件下能够氧化盐酸生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O,生成的氯气中含有氯化氢和水蒸气,由于氯气难溶于饱和食盐水,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,所以答案是:饱和食盐水、浓硫酸;2Cl﹣+MnO2+4H+
Mn2++Cl2↑+2H2O,生成的氯气中含有氯化氢和水蒸气,由于氯气难溶于饱和食盐水,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,所以答案是:饱和食盐水、浓硫酸;2Cl﹣+MnO2+4H+ ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3.)①制备气体装置,加入药品前首先要进行的实验操作是:检验装置气密性;装置D中应选择药品为碱石灰,碱石灰是氧化钙和氢氧化钠的混合物,氧化钙与水可反应,氢氧化钠可作干燥剂,且与盐酸能反应,所以该装置的作用是吸收水蒸气和部分氯化氢气体,
所以答案是:检验装置的气密性;除去H2中的H2O和HCl;
②LiH与水反应生成LiOH、H2 , 反应方程式为:LiH+H2O=LiOH+H2↑,
所以答案是:LiH+H2O=LiOH+H2↑; ③设LiH与Li的物质的量分别为xmol、ymol,则:
LiH | + | H2O | = | H2↑ | + | LiOH | |||
xmol | xmol | ||||||||
LiH | + | 2H2O | = | 2LiOH | + | H2↑ | |||
ymol | 0.5y mol | ||||||||
则 ![]() ,
,
解得x=0.012、y=0.002
故LiH与Li的物质的量之比为0.012mol:0.002mol=6:1,
所以答案是:6:1.
【考点精析】本题主要考查了氨的实验室制法的相关知识点,需要掌握安验室制法:用铵盐与碱共热,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】牛通过吃草,从草中获得化合物和元素,那么,牛和草的化学元素的种类以及相同化学元素的含量分别是( )
A. 种类差异很大,含量大体相同
B. 种类和含量差异都很大
C. 种类和含量都是大体相同
D. 种类大体相同,含量差异很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,某碱MOH的电离平衡常数Kb=1.0×10-5;电离度a=![]() 。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是
。在20.00mL0.1000mol/LMOH溶液中滴加0.10mol/L盐酸,测得溶液的pH、温度与所加盐酸的体积的关系如图所示。下列说法不正确的是
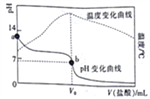
A. a点对应的溶液中:c(OH-)=(M+)+<(H+)
B. b点对应的V。=20.00mL
C. 298K时,0.1000mol/LMOH溶液中,MOH的电离度a=1%
D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,溶液的pH>9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在A1C13和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH的体积为l L)
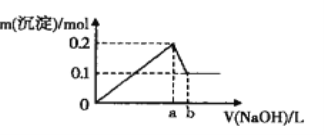
则下列判断正确的是
A. 图中线段oa:ab=3:l B. NaOH溶液物质的量浓度为0.6 mol·L-1
C. 在b点处溶液中的溶质只有NaAlO2 D. 混合溶液中Al3+与Mg2+物质的量比值为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣的一种或几种,取该溶液进行实验,实验内容如下: 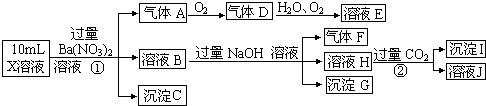
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是;
(2)写出有关离子方程式:步骤①中生成A;步骤②生成沉淀I;
(3)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,而沉淀C物质的量0.07mol,能说明(1)中不能确定的阴离子存在的理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.SO2 , CO2 , SiO2中的S,C,Si均为sp3杂化
B.SO32﹣ , CO32﹣ , SiO32﹣均为平面三角形
C.H3O+ , NH4+ , [Cu(NH3)4]2+均含有配位键
D.石墨、新型高分子导电材料聚乙炔、金属晶体均含有金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素(其结构如下图所示)是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是
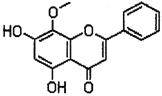
A. 汉黄芩素的分子式为C16H13O3
B. 汉黄芩素遇FeCl3溶液显色
C. lmol汉黄芩素与溴水反应,最多消耗2molBr2
D. 汉黄芩素与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com