
����Ŀ��I�� ��ͼ��ʾ��U�ιܵ���˱�ˮ�ͽ�������м���������������Ϊ1��4���Ļ�����壬�ٶ�������ˮ�е��ܽ�ȿ��Ժ��ԣ�������м���������Ļ�������װ�÷������й�ĵط����û�����建���ط�Ӧһ��ʱ�䡣

��1����������������������Ϊ1��4����Ӧ��֣���ֻ����һ���л����д����ѧ����ʽ____________________________________��
��2����������Сʱ�ķ�Ӧ��U�ι��Ҷ˵IJ�������ˮ���仯��______������ĸ��ţ�
A������ B������ C������ D����ȷ��
II ����ʵ��������ȡ��ϩ�ķ�ӦΪ��![]() �������¶ȿ��Ʋ�������������Ӧ�����������ͼʵ����ȷ�������������������ϩ�Ͷ�������
�������¶ȿ��Ʋ�������������Ӧ�����������ͼʵ����ȷ�������������������ϩ�Ͷ�������

��3����ϩʹ��ˮ��ɫ�Ļ�ѧ����ʽ��______________________________��
��4��I ��II��III����װ�ÿ�ʢ�ŵ��Լ��ǣ���������ĸ���ţ���
I ______�� II ______�� III ______�� �� ______��
A��Ʒ����ҺB��NaOH��ҺC��ŨH2SO4 D����ˮ
��5��ȷ�Ϻ�����ϩ�������� _________________________________��
���𰸡�![]() B
B![]() ABADװ��III����Һ����ɫ��װ��IV����Һ��ɫ
ABADװ��III����Һ����ɫ��װ��IV����Һ��ɫ
��������
����������ڹ��յ������¿��Է���ȡ����Ӧ������һ�ȼ��顢���ȼ��顢���ȼ��������Ȼ�̼���Ȼ��⣬һ�ȼ�����Ȼ��������壬�ȴ��鲻����ˮ���Ȼ��⼫������ˮ��Ҫ֤������������ϩ�Ͷ�������Ӧ�ȸ��ݶ��������Ư���Լ����������Ȼ��������������Һ��ȥ���������������ˮ������ϩ��
I����1����������������������Ϊ1��4����Ӧ��֣���ֻ����һ���л����Ӧ����Ϊ���Ȼ�̼���Ȼ��⣬�÷�Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
��2����������Сʱ�ķ�Ӧ�����Ȼ�������ˮ������Һ̬���ﵼ�������ѹ��С����U�ι��Ҷ˵IJ�������ˮ���½���ѡB ��
II ����3����ϩʹ��ˮ��ɫ�Ļ�ѧ����ʽ��![]() ��
��
��4����ʵ��Ŀ�Ŀ�֪��I���ڼ����������ͨ����Ʒ����Һ��II�������ն�������ͨ����NaOH��Һ��III���ڼ���������Ƿ��������Ʒ����Һ��IV���ڼ�����ϩ������ˮ������I��II��III��IVװ�ÿ�ʢ�ŵ��Լ���A��B��A��D��
��5��ȷ�Ϻ�����ϩ����������װ��III����Һ����ɫ��װ��IV����Һ��ɫ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ļ���Ԫ�ذ���
A. C��H��O��N B. K��Na��Ca��Mg��Cl��Fe
C. P��S D. Cu��Co��I��Mn
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����У����ۼ����ƻ�����()
A.���ڻ�B.KOH�ڻ�C.NH4HSO4����ˮD.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪W��X��Y��ZΪ������Ԫ�أ�W��Zͬ���壬X��Y��Zͬ���ڣ�W����̬�⻯����ȶ��Դ���Z����̬�⻯���ȶ��ԣ�X��YΪ����Ԫ�أ�X�������ӵ�������С��Y�������ӵ������ԣ�����˵����ȷ����
A. X��Y��Z��W��ԭ�Ӱ뾶���μ�С
B. W��X�γɵĻ�������ֻ�����Ӽ�
C. W����̬�⻯��ķе�һ������Z����̬�⻯��ķе�
D. ��W��Y��ԭ���������5��������γɻ�����Ļ�ѧʽһ��ΪY2W3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʼ���ˮ�У����������ȵ���
A. �ռ� B. Ũ���� C. ʳ�� D. ��ʯ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�NaOH��Һʱ��ѡ�������ָʾ��������գ�
��1����ͼ1�dz��������IJ��ֽṹ��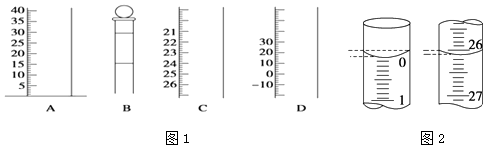
�����������BC
��ʹ��ǰ�����Ƿ�©ˮ�������� ��
��2���ñ�������ζ������NaOH��Һʱ����������ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ע�� �� �ζ��յ�ʱ����ƿ����ɫ�仯Ϊ �� �Ұ��������ɫ����ԭ��
��3�����в����п���ʹ����NaOH��Һ��Ũ����ֵƫ�͵���
A.��ʽ�ζ���δ�ñ�������ϴ��ֱ��ע�������
B.�ζ�ǰʢ��NaOH��Һ����ƿ������ˮϴ����û�и���
C.��ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D.��ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
��4�����ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ2��ʾ������������Һ�����ΪmL��
��5��ijѧ������3��ʵ��ֱ��¼�й����������
�ζ� | ����NaOH��Һ�����/mL | 0.100 0mol/L��������/mL | ||
�ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
��һ�� | 25.00 | 0.00 | 25.11 | 25.11 |
�ڶ��� | 25.00 | 0.56 | 30.56 | 30.00 |
������ | 25.00 | 0.22 | 25.11 | 24.89 |
���ݱ�������ʽ�����NaOH��Һ�����ʵ���Ũ�� �� ��������λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ķ������������������ϣ�
����һ����ͼ
���϶������
���� | �۵�/�� | �е�/�� | �ܶ�/gcm��3 | �ܽ��� |
�Ҷ���C2H6O2 | ��11.5 | 198 | 1.11 | ������ˮ���Ҵ� |
������C3H8O3 | 17.9 | 290 | 1.26 | ��ˮ���ƾ�������Ȼ��� |
�����������ϼ��α�֪ʶ���ش��������⣨ÿ��ֻ��һ����ĸѡ�����
A������ B����ȡ�� C�����ܽ⡢�ᾧ�����ˡ��ķ��� D����Һ��
��1���������ͺ�ˮ����ѷ�������
��2��ȥ�������е������Ȼ������ʣ����Ӧ����
��3�����Ҷ����ͱ�������������ѷ����� �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ������ҵ��չ�̲��ž�DZ����Ŀǰ��ȫ��������������ǰ��λ��Ϊͭ������Ǧ��п�������ش��������⡣
��1��ͭԭ�ӵĵ���ռ��________��������ͬ��ԭ�ӹ������Ԫ�����ڱ�������ǦԪ�ش������ڱ���_____����
��2�����������ڣ���ͼ���Ļ�ѧ����____________������ţ���

A.��� B.���Ӽ� C.���ۼ� D.������ E.��λ��
��3���ܶ�����л�����Ni���¿�����H2�����ӳɷ�Ӧ�����CH2=CH2����CH![]() CH���۱�����HCHO��,���з�����Cԭ��Ϊsp�ӻ�����___________����������ţ���Ԥ��Ҽ���м���ֵΪ3��1�ķ��ӵ�����ṹΪ_______________�Ρ�
CH���۱�����HCHO��,���з�����Cԭ��Ϊsp�ӻ�����___________����������ţ���Ԥ��Ҽ���м���ֵΪ3��1�ķ��ӵ�����ṹΪ_______________�Ρ�
��4������п������Ҫ��п�Σ�Ϊ��ɫб��������ɫ��ĩ������ˮ����(ZnSO4��7H2O) �׳�𩷯����һ����Ȼ�������SO42-������ṹͼ����ͼ���У��軭����ԭ�ӣ���ʵ��Բ�㡰![]() ����ʾ������ԭ�ӣ��ÿ���Բ�㡰O����ʾ����λ�á�_____________
����ʾ������ԭ�ӣ��ÿ���Բ�㡰O����ʾ����λ�á�_____________

��5�����������������Դ����(La)����(Ni)�ĺϽ����������ϡ�
�����й��ڸ�������ϼ�������˵������ȷ����__________������ţ���
A.�ò�������ԭ�Ӻ���ԭ��֮����ڻ�ѧ������ԭ�Ӿ���
B.��֪������ĵ�һ�����ֱܷ�Ϊ5.58eV��7.64eV���ɼ���̬��ԭ�ӱ���̬��ԭ�Ӹ����ױ��+1�۵���̬������
C.����ӱ�����ʱ����Ҫ�ںϽ�����������ԭ�ӣ�ͬʱ�ų�����
D.�ò�������ʱ���ó��¸�ѹ�Ȳ��ó��³�ѹ����
E.��������Һ������Ϊ��Ȼ������������ǿ��������Ӽ�����������
�ڸúϽ�ľ�����ͼ��ʾ����������ϵ������н�Ϊ60��(120��)�����ⶨ��������a=511pm��c=397pm������������һ����ԭ�ӣ�������ԭ�Ӷ��ھ������ϣ���ԭ�Ӷ��ھ��������ϣ��þ���Ļ�ѧʽΪ_______________����ÿ������������3��H2�����������뾧����϶��������䣩�þ������ܶȼ���ʽΪ___________________________��(NA��ʾ�����ӵ�����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]X��Y��Z��W��R���ֶ����ڷǽ���Ԫ��ԭ��������������X��Y��Z��WΪͬ����Ԫ����δ�ɶԵ�����֮��Ϊ1:2:3:2��R��Zͬ���塣��ش��������⣺
��1��Z�Ļ�̬ԭ�ӵļ۲�����Ų�ͼΪ______________________________��
��2��Z��W��R ����Ԫ�صĵ縺���ɴ�С��˳��Ϊ_____________����Ԫ�ط��ű�ʾ����
��3��W�ij����⻯�������ļ���С��HF����ļ��ܣ���W�ij����⻯�ﳣ����ΪҺ̬��HF������Ϊ��̬��ԭ����_______________________________��
��4��ij�ַ���ʽΪY4Z4W8�����ʣ���������ͬ��ԭ�ӵĻ�ѧ������ȫ��ͬ������̼̼˫������һ��������ǿ��ըҩ�������֪��ṹ��ʽΪ_________________________��
��5��XR��һ����ĥ���ϣ�����X�����廯���R�����廯���ڸ������������ķ�Χ�кϳɡ�
��X�����廯�������Xԭ�ӵ��ӻ���ʽΪ_______________��R�����廯����ӵĿռ乹�͵�����Ϊ_____________________��
�ںϳ�XR�Ļ�ѧ����ʽΪ_____________________��
��6��Y��W�γɵ�ij�ֳ���������ľ�����ͼ�� �þ����з��ӵ���λ��Ϊ__________________�����������ⳤΪa nm�������ӵ�������ֵΪNA��������ܶ�Ϊ______g/cm3��
�þ����з��ӵ���λ��Ϊ__________________�����������ⳤΪa nm�������ӵ�������ֵΪNA��������ܶ�Ϊ______g/cm3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com