
【题目】PCl5(g)一定条件下可以转化成PCl3(g)或红磷P(s).
(1)已知: PCl5(g)═PCl3(g)+Cl2(g)△H1K1
PCl3(g)═P(s)+ ![]() Cl2(g)△H2K2
Cl2(g)△H2K2
K1、K2表示该反应的平衡常数.
则PCl5(g)═P(s)+ ![]() Cl2(g)该反应的△H=(用△H1、△H2表示),反应的平衡常数K=(用K1、K2表示).
Cl2(g)该反应的△H=(用△H1、△H2表示),反应的平衡常数K=(用K1、K2表示).
(2)在210℃时,将4mol PCl3气体充入1L真空恒容密闭容器中发生反应:2PCl3(g)═2P(s)+3Cl2(g) 测得数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(PCl3)/mol | 4 | 2.8 | 2 | 1 | 1 |
并测得反应达到平衡时热量变化数值为Q,反应平衡常数为K,PCl3转化率为α.
①0~30min时,用Cl2表示该反应的反应速率为;平衡时,PCl3转化率α=;该温度下反应的平衡常数K= .
②其它条件保持不变,若上述反应在恒压条件下进行反应,达平衡时测得热量变化数值、平衡常数、PCl3转化率分别为Q′、K′、α′,则Q′(填“>”“<”或“=”,下同)Q,K′K,α′α.
③保持其它条件不变,若向上述平衡体系中再充入1molCl2(g)、1molP(s)和1molPCl3(g),则上述平衡反应(填“正向”、“逆向”或“不”)移动.
【答案】
(1)△H1+△H2;K1×K2
(2)0.15mol/(L.min);75%;91.125;>;=;>;正向
【解析】解:(1)①PCl5(g)═PCl3(g)+Cl2(g)△H1 K1②PCl3(g)═P(s)+ ![]() Cl2(g)△H2 K2
Cl2(g)△H2 K2
结合盖斯定律可知,①+②得到PCl5(g)═P(s)+ ![]() Cl2(g),
Cl2(g),
则该反应的△H=△H1+△H2 , 反应的平衡常数K=K1×K2 ,
所以答案是:△H1+△H2;K1×K2;(2)①由表格数据可知,30min达到平衡,则
2PCl3(g) | ═ | 2P(s)+ | 3Cl2(g) | |
开始 | 4 | 0 | ||
转化 | 3 | 4.5 | ||
平衡 | 1 | 4.5 |
0~30min时,用Cl2表示该反应的反应速率为 ![]() =0.15mol/(L.min);
=0.15mol/(L.min);
平衡时,PCl3转化率α= ![]() ×100%=75%;
×100%=75%;
该温度下反应的平衡常数K= ![]() =91.125,
=91.125,
所以答案是:0.15mol/(L.min);75%;91.125;
②若上述反应在恒压条件下进行反应,反应的物质的量增大,体积增大,相等于减小压强,则平衡正向移动,则Q′>Q,α′>α,K只与温度有关,K′=K,
所以答案是:>;=;>;
③向上述平衡体系中再充入1molCl2(g)、1molP(s)和1molPCl3(g),Qc= ![]()
![]() =41.59<K,则反应正向移动,所以答案是:正向.
=41.59<K,则反应正向移动,所以答案是:正向.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热,以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的氯化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)请写出Fe与水蒸气反应的化学方程式:_____________。
(2)在实验室中,FeCl2可用铁粉和______(填名称)反应制备。
(3)Fe3O4可用多种方法制得,其中由一种单质和一种化合物通过化合反应制备的化学方程式为______。
(4)红砖是用黏土高温烧结而成的,因其含有Fe2O3呈红色或棕红色而得名,常用作建筑材料。请设计一个简单实验证明红砖中含有Fe3+:_________________。
(5)现有一含有FeCl2 和FeCl3的混合物样品,实验测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为_________。
(6)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从石油裂解中得到的1,3-丁二烯可进行以下多步反应,得到氯丁橡胶和富马酸。
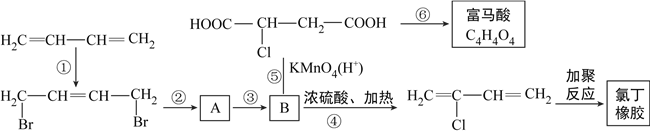
(1)B的名称为2-氯-1,4-丁二醇,请你写出B的结构简式____________________。
(2)请你写出第②步反应的化学方程式:______________________________。
(3)反应①~⑥中,属于消去反应的有______________________________。
(4)有机合成中的路线和步骤选择非常重要,若将第②步和第③步的顺序调换,则B结构将是____________________。
(5)如果没有设计③和⑥这两步,直接用KMnO4/H+处理物质A,导致的问题是:______________________________。
(6)某种有机物的分子式为C5H6O4,它的分子中所含官能团的种类、数目均与富马酸相同,不考虑顺反异构,它可能的结构有__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)最简单的烃分子空间构型为____________________。
(2)衡量一个国家石油化工水平的标志是__________(填名称)的产量。
(3)2,4,6-三硝基甲苯(TNT)的结构简式为____________________。
(4)经催化加氢后生成异戊烷的炔烃结构简式为____________________。
(5)能用高锰酸钾溶液鉴别的是__________(填选项)
a.裂化汽油和直馏汽油 b.苯和甲苯
c.顺-2-丁烯和反-2-丁烯 d.乙醇和甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图浓硫酸配制稀硫酸,下列说法正确的是( )

A. 若需要配制200mL1.00 mol·L –1的稀硫酸,通过计算后,用10mL量筒量取9.20mL浓硫酸
B. 浓硫酸与等质量的水混合后冷却,所得溶液的浓度大于9.2mol·L –1
C. 若定容时加水超过刻度线后,应用胶头滴管吸出多余的液体
D. 向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:某废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关图像如下所示:
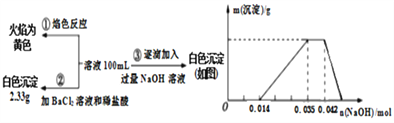
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是______________,一定存在的阳离子是______________________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:_____________________________________________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为________,所得沉淀的最大质量是____g。
(4)若通过实验确定原废水中c(Na+)=0.14 mol·L-1,c(NO3-)=____________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液化气的主要成分是丙烷,下列有关丙烷的叙述不正确的是( )
A.是直链烃,但分子中3个碳原子不在一条直线上
B.在光照条件下能够与氯气发生取代反应
C.丙烷比丁烷沸点高
D.1 mol丙烷完全燃烧消耗5 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答:
(1)乙烯的电子式为____________,结构简式为__________________。
(2)下列可以鉴别甲烷和乙烯的试剂为______(填选项字母)。
A.稀硫酸 B.溴的四氯化碳溶液
C.水 D.酸性高锰酸钾溶液
(3)下列物质中,不能通过乙烯加成反应得到的是________(填选项字母)。
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
(4)已知:2CH3CHO+O2![]() 2CH3COOH,以乙烯为主要原料合成乙酸,合成路线如下图所示:
2CH3COOH,以乙烯为主要原料合成乙酸,合成路线如下图所示:
![]() ①,A
①,A![]() B
B![]()
![]()
反应③的反应类型为__________________反应,反应②的化学方程式为________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com