



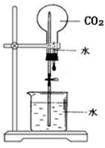
| A.除去乙烷中混有的乙烯 | B.石油蒸馏 | C.乙醇催化氧化 | D.CO2喷泉实验 |
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
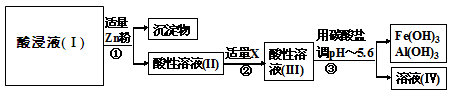
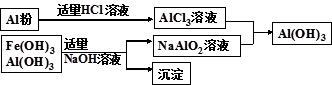
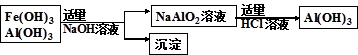
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定有Cl- | B.一定有SO42- | C.一定没有Al3+ | D.一定没有CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
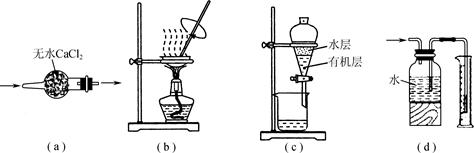
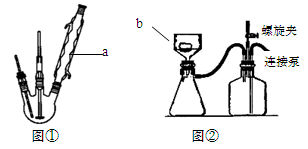
| A.用图a所示装置干燥SO2气体 |
| B.用图b所示装置蒸发CH3COONa溶液得醋酸钠晶体 |
| C.用图c所示装置分离有机层与水层,水层从分液漏斗下口放出 |
| D.用图d所示装置测量氯气的体积 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 、SO
、SO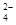 离子的实验方法正确的是________(填编号)。
离子的实验方法正确的是________(填编号)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
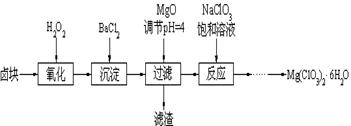

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 实验操作 | 实验现象与结论 |
| 取适量溶液B于试管中,滴加 ,振荡 ,放置一段时间后,观察现象。 | 若溶液 ,则溶液B中含Cl2; 若溶液 ,则溶液B中不含Cl2。 |
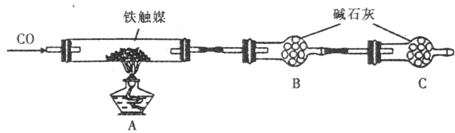
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com