
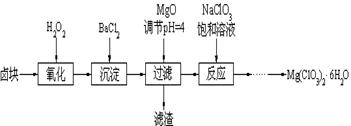



科目:高中化学 来源:不详 题型:单选题
A.实验室用溴水和苯在催化剂作用下制溴苯: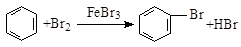 |
| B.工业上用H2冶炼金属钠:Na2O+H2△2Na+H2O |
| C.向溴乙烷中滴加AgNO3检验其中的溴原子:Ag++Br—=AgBr↓ |
| D.用氢氟酸雕刻玻璃:SiO2+4HF=SiF4↑+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
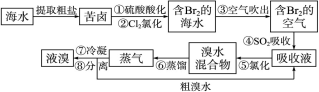
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、短颈玻璃漏斗 | 苯甲酸的重结晶 |
| B | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中少量NaI |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体NaCl配制0.5 mol/L NaCl溶液 |
| D | 烧杯、玻璃棒、胶头滴管 | 用盐酸除去BaSO4中少量BaCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
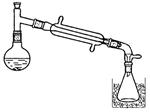
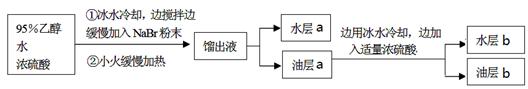
| 实验步骤 | 预期现象和结论 |
| 步骤1:将油层b转移至 中,再加入足量稀 Na2SO3溶液充分振荡,静置。 | |
| 步骤2:取步骤1的水层少量于试管中,加入稀硫酸酸化,再加入适量新制氯水及少量CCl4,充分振荡,静置。 | 溶液分层,下层呈橙红色,证明 。 |
| 步骤3:将步骤1的油层充分洗涤、干燥后装入蒸馏装置中, 至温度计升高至450C左右。 | 馏出蒸汽的温度稳定在38℃左右,不再有蒸汽馏出时,将蒸馏烧瓶中残留液体置于冰水浴中冷却,凝结成白色固体,则证明油层b中含有1,2-二溴乙烷。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 物质 | 杂质 | 试剂 | 方法 |
| A | 甲烷 | 乙烯 | 酸性高锰酸钾溶液 | 洗气 |
| B | 氯化亚铁溶液 | 氯化铁 | 过量铁粉 | 过滤 |
| C | 二氧化硅 | 氧化铝 | 氢氧化钠溶液 | 过滤 |
| D | 乙酸乙酯 | 乙酸 | 饱和碳酸钠溶液 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验目的 | 操作 |
| A | 检验淀粉水解产物有还原性 | 淀粉溶液和稀H2SO4混合加热,冷却后,再加新制的Cu(OH)2悬浊液加热至沸腾 |
| B | 证明SO2具有漂白性 | 将SO2通入溴水中 |
| C | 为了提取溴水中的溴 | 加入植物油进行萃取 |
| D | 浓、稀HNO3分别与Cu反应 | 比较浓、稀HNO3的氧化性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com