
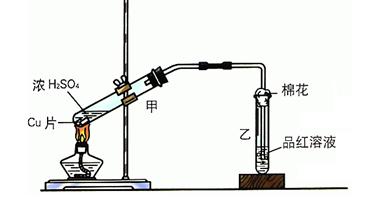
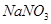 溶液,发现铜片溶解,此反应的离子方程式为 。
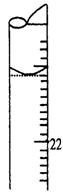
溶液,发现铜片溶解,此反应的离子方程式为 。| A.40.32L | B.30.24L | C.20.16L | D.13.44L |
科目:高中化学 来源:不详 题型:填空题
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.检验酒精中的少量水:向酒精中加入足量生石灰 |
| B.鉴别集气瓶中的甲烷和乙烯:移去玻璃片,分别点燃,观察火焰的颜色及是否有黑烟 |
| C.制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 |
| D.制取乙酸乙酯:用如图所示的实验装置 |
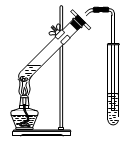
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 ×100℅)
×100℅)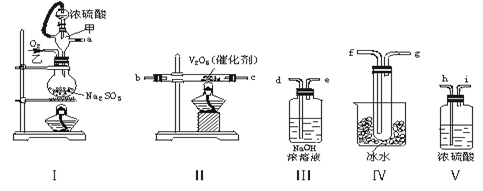
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
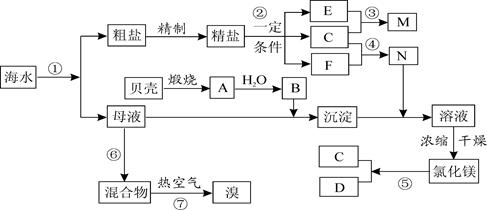
 单质处循环
单质处循环 (填“甲”或“乙”),理由是 。
(填“甲”或“乙”),理由是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
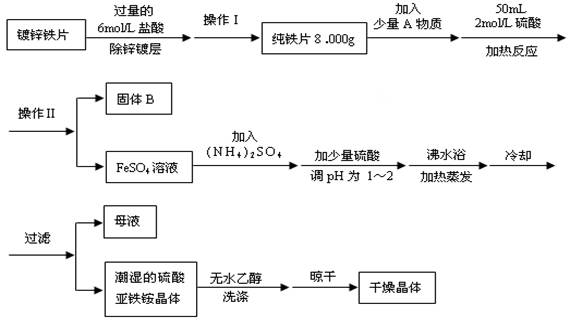
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com