
 ×100℅)
×100℅)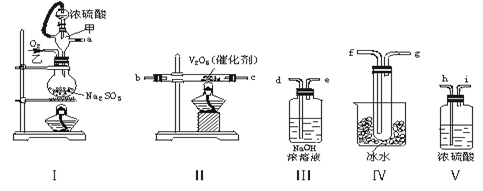
 ×100%或
×100%或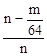 ×100%
×100% mol,而产生的SO2的总物质的量为n mol,故实验中SO2的转化率(2SO2+O2
mol,而产生的SO2的总物质的量为n mol,故实验中SO2的转化率(2SO2+O2 2SO3)为
2SO3)为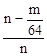 ×100%
×100%

科目:高中化学 来源:不详 题型:实验题
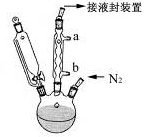
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| | 苯甲酸 | 甲醇 | 苯甲酸甲酯 |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
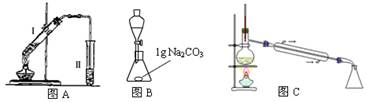
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
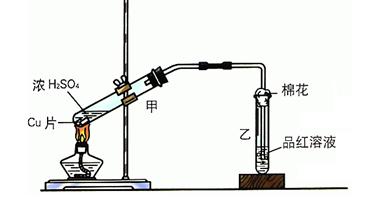
 溶液,发现铜片溶解,此反应的离子方程式为 。
溶液,发现铜片溶解,此反应的离子方程式为 。| A.40.32L | B.30.24L | C.20.16L | D.13.44L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
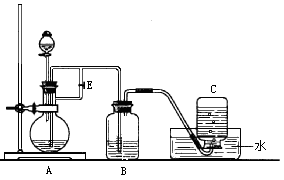
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com