
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3 , 其流程如下: 
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+
(1)加入FeS2还原后,检验Fe3+是否反应完全的试剂为 .
(2)所得FeCO3需充分洗涤,检验是否洗净的方法是 . “沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是 .
(3)①写出“还原”时反应Ⅱ的离子方程式: .
(4)②“还原”前后溶液中部分离子的浓度见下表(溶液体积变化或略不计):
离子 | 离子浓度(molL﹣1) | |
还原前 | 还原后 | |
Fe2+ | 0.10 | 2.5 |
SO42﹣ | 3.5 | 3.7 |
请计算反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比(写出计算过程).
【答案】
(1)KSCN溶液
(2)取最后一次洗涤滤液,滴加氯化钡溶液,看溶液是否有沉淀,若无沉淀,则已经洗涤干净;氢氧化铁
(3)2Fe3++S2﹣=2Fe2++S↓
(4)解:根据表可知,反应Ⅰ中生成的硫酸根的浓度为0.2molL﹣1,据反应FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+可知,反应Ⅰ中被还原的Fe3+的物质的量浓度为1.4molL﹣1,同时计算出生成的亚铁离子的浓度为1.5molL﹣1,两个反应中共生成的亚铁离子的浓度为2.4molL﹣1,所以反应Ⅱ中生成的亚铁离子浓度为0.9molL﹣1,根据2Fe3++S2﹣=2Fe2++S↓可知,Ⅱ中被还原的Fe3+的物质的量浓度为0.9molL﹣1,所以反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为1.4molL﹣1:0.9molL﹣1=14:9,
答:反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为14:9
【解析】解:烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)用硫酸浸取,过滤后滤液中含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣为二氧化硅,用二硫化亚铁矿还原Fe3+后过滤,得滤液中含有硫酸亚铁,向滤液中加入碳酸铵,过滤得碳酸亚铁,滤液中有硫酸铵,(1)检验Fe3+常用KSCN溶液,看溶液是否呈血红色,所以检验Fe3+是否反应完全的试剂为KSCN溶液,
所以答案是:KSCN溶液;(2)过滤得碳酸亚铁,滤液中有硫酸铵,所以检验FeCO3是否洗净,就是检验洗涤滤液中是否有硫酸根离子,所以操作为取最后一次洗涤滤液,滴加氯化钡溶液,看溶液是否有沉淀,若无沉淀,则已经洗涤干净,“沉淀”时,pH过高时溶液中的亚铁离子会生成氢氧化亚铁,进而生成氢氧化铁,
所以答案是:取最后一次洗涤滤液,滴加氯化钡溶液,看溶液是否有沉淀,若无沉淀,则已经洗涤干净;氢氧化铁;(3)①根据流程可知,“还原”时反应Ⅱ有硫产生,应为硫离子与铁离子之间的氧化还原反应,反应的离子方程式为2Fe3++S2﹣=2Fe2++S↓,
所以答案是:2Fe3++S2﹣=2Fe2++S↓;


科目:高中化学 来源: 题型:
【题目】标号为①~⑩的元素,在元素周期表中的位置如下:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)其原子只要形成一对共用电子对就达到了稳定结构的元素是(填写元素符号).
(2)①和④号元素形成的化合物的化学式为 , 用电子式表示其形成过程为 .
(3)⑧号元素的最高价氧化物的水化物的化学式是 .
(4)①、⑤、⑦号元素形成的一种化合物的电子式是 , 在该化合物中既含有键,又含有键.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下将SO2和Cl2按1:1体积比混合后,通入BaCl2和品红的混合溶液中,下列说法正确的是( )
A.溶液褪色,无沉淀生成B.溶液不褪色,无沉淀生成
C.溶液褪色,有沉淀生成D.溶液不褪色,有沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.向明矾溶液中加入氢氧化钡溶液至沉淀的物质的量达到最大值:Al3++2SO ![]() +2Ba2++4OH﹣═2BaSO4↓+AlO
+2Ba2++4OH﹣═2BaSO4↓+AlO ![]() +2H2O
+2H2O
B.向澄清石灰水中通入少量CO2:OH﹣+CO2═HCO ![]()
C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2CH3COOH═Ca2++2CH3COO﹣+H2O+CO2↑
D.硝酸银溶液中加入铜粉:Ag++Cu═Cu2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成导电高分子化合物PPV的反应为: ![]()
下列说法正确的是( )
A.PPV是聚苯乙炔
B.该反应为缩聚反应
C.PPV与聚苯乙烯的最小结构单元组成相同
D.1 mol ![]() 最多可与2 mol H2发生反应
最多可与2 mol H2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人类发现的第二个生命体必须微量元素,回答下列问题:
(1)碘是氯的同族元素,它们位于元素周期表第族;HI的稳定性比HCl(填“强”或“弱”,下同),HI的还原性比HCl
(2)为了从海带中提取碘,某研究性学习小组设计并进行了如图实验: 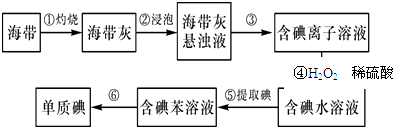
步骤①需要在(填仪器名称)中进行.步骤④反应的离子方程式是 . 步骤⑤中应进行的操作名称是
(3)自然界中的碘有的以NaIO3形态,加入NaHSO4可以制得I2 , 反应为:(未配平)IO3﹣+HSO3﹣→I2+SO42﹣+H++H2O,若制得1mol I2 , 则转移的电子数目为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2是一种重要的化工原料,结合氯气的相关知识解决下列问题.
(1)运输氯气的钢瓶上应贴的标签为 .
A.腐蚀品
B.爆炸品
C.有毒品
D.易燃品
(2)工业上将氯气通入石灰乳制取漂白粉,写出该反应的化学方程式 .
(3)漂白粉的有效成分是(填化学式) .
(4)实验室可以用KMnO4与浓盐酸在常温下制备Cl2 . 高锰酸钾溶液常用于物质的定性检验与定量分析.某化学兴趣小组在实验室里欲用KMnO4固体来配制500mL 0.1mol/L的KMnO4溶液.①需用的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、 .
②下列操作会导致实验结果偏小的是(填字母).
a.转移时没有洗涤烧杯、玻璃棒
b.容量瓶内壁附有水珠而未干燥处理
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
d.加水定容时俯视刻度线
③用配好的该浓度的KMnO4溶液与300mL 0.2mol/L的KI溶液恰好反应,生成等物质的量的I2和KIO3 , 则消耗KMnO4的体积为mL.(已知MnO4﹣在此条件被还原为Mn2+)
(5)氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量,已知:Cl2+2Br﹣=2Cl﹣+Br2 ).①能证明氯水具有漂白性的是(填“a”、“b”、“c”或“d”),现象是.②a中发生反应的离子方程式是.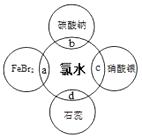
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CrO42﹣+2H+Cr2O72﹣+H2O.25℃时,调节初始浓度为1.0molL﹣1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72﹣)和c(H+),获得如图所示的曲线.下列说法不正确的是( ) 
A.平衡时,pH越小,c(Cr2O72﹣)越大
B.A点CrO42﹣的平衡转化率为50%
C.A点CrO42﹣转化为Cr2O72﹣反应的平衡常数K=1014
D.平衡时,若溶液中c(Cr2O72﹣)=c(Cr2O42﹣),则c(H+)>2.0×10﹣7 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳有三种常见的同位素:12C、13C、14C,氧也有三种同位素:16O、17O、18O,由这六种微粒构成的二氧化碳分子最多有( )
A. 8种B. 12种C. 18种D. 24种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com