
【题目】实验室常用浓盐酸与高锰酸钾发生反应快速制备少量氯气。化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。
(1)用单线桥法表示该反应过程中的电子转移情况。______
(2)该反应中Cl2是___(填氧化剂、还原剂、氧化产物或还原产物),HCl被氧化部分和未被氧化部分之比为___。

已知:氯气有毒,溶入水显酸性(反应方程式为Cl2+H2O=HCl +HClO)。氯气在饱和食盐水中的溶解度很小,氯化氢在饱和食盐水中的溶解度则很大。
(3)装置C的作用是___,装置D的作用是____,为了避免尾气排入空气污染环境,装置F中的试剂是___。
(4)氯气与水反应过程中,氧化剂和还原剂之比为___。
【答案】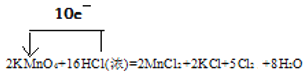 氧化产物 5:3 除HCl 干燥氯气 NaOH溶液/KOH溶液 1:1
氧化产物 5:3 除HCl 干燥氯气 NaOH溶液/KOH溶液 1:1
【解析】
(1)在反应中,Mn的化合价由+7价降低到+2价,得到电子,2molKMnO4得到10mol电子。盐酸中的氯的化合价升高,由-1价升高到0价,16molHCl中只有10mol发生了氧化反应,另外的6mol没有发生化合价的变化,10molHCl失去10mol电子。故用单线桥法表示该反应过程中的电子转移情况为: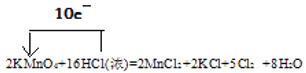 。
。
(2)该反应中Cl2是由HCl中的-1价的氯化合价升高得到的,所以是氧化产物,16molHCl中被氧化的为10mol,未被氧化部分的为6mol,故被氧化部分和未被氧化部分之比为5:3。故答案为:氧化产物,5:3。
(3)由于浓盐酸挥发,所以氯气中会混有HCl和水蒸气,氯气在饱和食盐水中的溶解度很小,氯化氢在饱和食盐水中的溶解度则很大,所以可以用饱和食盐水除去氯气中的HCl,用浓硫酸除去氯气中的水蒸气。应先除HCl,再除水蒸气,如果先除去水蒸气,再通过饱和食盐水除去HCl的同时又会带出水蒸气,所以装置C的作用是除HCl,装置D的作用是干燥氯气,为了避免尾气排入空气污染环境,可以用NaOH溶液或KOH溶液吸收多余的氯气,故装置F中的试剂是NaOH溶液/KOH溶液。故答案为:除HCl,干燥氯气,NaOH溶液或KOH溶液。
(4)氯气与水反应为:Cl2+H2O![]() HCl+HClO,Cl2中的氯元素的化合价既升高又降低,所以Cl2既是氧化剂又是还原剂,而且1moLCl2中的2molCl,其中1molCl的化合价升高到+1价,另1molCl的化合价降低到-1价,所以氧化剂和还原剂之比为1:1。
HCl+HClO,Cl2中的氯元素的化合价既升高又降低,所以Cl2既是氧化剂又是还原剂,而且1moLCl2中的2molCl,其中1molCl的化合价升高到+1价,另1molCl的化合价降低到-1价,所以氧化剂和还原剂之比为1:1。


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】已知0.5L的NaCl溶液中含有0.5molNa+。下列关于该溶液的说法不正确的是( )
A. 该溶液中溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有58.5gNaCl
C. 配制1000mL该溶液需用58.5gNaCl
D. 量取100mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。

①金属C的名称_______
②气体丙的分子式___________
③写出下列反应的化学方程式:反应①___________________________;反应⑥________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中HCO3―、CO32―、H2CO3 三种微粒的浓度由大到小的顺序为:_______________________________。
(2)NaHCO3溶液与硫酸铝溶液混合的离子方程式_______________________________。
(3)Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液与某浓度盐酸溶液按体积比(碱与酸之比)1 :9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物( )是良好的生物可降解材料,其合成路线如下:
)是良好的生物可降解材料,其合成路线如下:

已知: (R,R’,R’’代表烷基或H)
(R,R’,R’’代表烷基或H)
(1)已知A的核磁共振氢谱有二个峰,A的结构简式是_______。
(2)B可使澄清的苯酚钠水溶液变浑浊,B中的含氧官能团名称是________。
(3)B与试剂a在一定条件下反应生成C的化学方程式是________。
(4)D转化为E的化学方程式是________。
(5)F的结构简式是________。
(6)由G生成H的化学方程式是________。
(7)聚合物P具有较好的可降解性,其原因是_________。
(8)以1,3-丁二烯为原料(无机试剂任选),设计J的合成路线________。合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,则下列说法正确的是
A. 18gD2O和18gH2O中含有的质子数均为10NA
B. 0.1mol·L-1的NaCl溶液中含有的Na+的数目为0.1NA
C. 11.2LCO2中含有的分子数为0.5NA
D. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯在医药工业中可作为有机合成的中间体,其中一种合成路线如下:

已知:①烃A是最简单的烯烃
②醛与醛能在一定条件下反应,原理如下:

回答下列问题:
(1)烃A的结构简式为____________。
(2)反应③的试剂和反应条件为___________;反应⑩的试剂和反应条件为______________;反应⑧的反应试剂______________(填“能”或“不能”)改用酸性高锰酸钾溶液,其原因是___________________。
(3)反应⑦的反应类型为______。
(4)H与银氨溶液反应的化学方程式为______________________。
(5)符合下列条件的I的同分异构体共有______种。
①除苯环外不含有其他环状结构;②能发生水解反应和银镜反应。
其中核磁共振氢谱显示为5组峰,且峰面积比为1:1:2:2:2的是______(写结构简式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容的密闭容器中通入SO2和NO2,发生反应SO2(g)+NO2(g) ![]() SO3(g)+NO(g),其正反应速率(v正)随时间(t)变化的关系如图所示。下列结论中错误的是( )
SO3(g)+NO(g),其正反应速率(v正)随时间(t)变化的关系如图所示。下列结论中错误的是( )

A. 反应在c点达到平衡状态
B. 反应物浓度:a点大于b点
C. 反应物的总能量高于生成物的总能量
D. 逆反应速率:c点大于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法不正确的是
A. 标准状况下3.6 g H2O含有的电子数为2NA
B. 2.8 g乙烯与聚乙烯的混合物含有的极性键为0.4NA
C. 0.l moI Cl2与足量的铁粉充分反应转移的电子数为0.2NA
D. 1 L 0.2 mol/l的K2Cr2O7溶液中![]() 的数目为0.2NA
的数目为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com