
【题目】设NA为阿伏加德罗常数的值,则下列说法正确的是
A. 18gD2O和18gH2O中含有的质子数均为10NA
B. 0.1mol·L-1的NaCl溶液中含有的Na+的数目为0.1NA
C. 11.2LCO2中含有的分子数为0.5NA
D. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.25NA
【答案】D
【解析】
A、根据n=![]() 并结合D2O、H2O中的电子数来计算;18g水的物质的量为1mol,水中含有10个质子,18gD2O物质的量不是1mol,含质子数不是1mol,含有质子数不同,选项A错误;
并结合D2O、H2O中的电子数来计算;18g水的物质的量为1mol,水中含有10个质子,18gD2O物质的量不是1mol,含质子数不是1mol,含有质子数不同,选项A错误;
B、0.1mol/L的NaCl溶液中,Na+与Cl-离子的浓度为0.1mol/L,离子数目与离子浓度、溶液体积有关,未告诉溶液体积,无法计算离子数目,选项B错误;
C、二氧化碳所处的状态不明确,不一定是标况,故11.2L二氧化碳的物质的量不一定是0.5mol,选项C错误;
D、标况下5.6L二氧化碳的物质的量为0.25mol,而过氧化钠与二氧化碳反应时,当1mol二氧化碳参与反应时,转移1mol电子,故0.25mol二氧化碳转移0.25mol电子即0.25NA个,选项D错误;
答案选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】锰是一种非常重要的金属元素,在很多领域有着广泛的应用。利用废铁屑还原浸出低品位软锰矿制备硫酸锰,然后进行电解,是制备金属锰的新工艺,其流程简图如下:
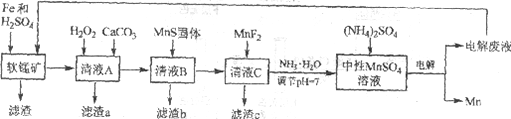
已知:
i. 低品位软锰矿主要成份有MnO2、Al2O3、Fe2O3、Cu2(OH)2CO3、CaCO3、SiO2等。
ii. 部分金属离子以氢氧化物沉淀时的pH
Fe2+ | Fe3+ | Al3+ | Mn2+ | Cu2+ | |
开始沉淀的pH | 6.8 | 1.8 | 3.7 | 8.6 | 5.2 |
沉淀完全的pH | 8.3 | 2.8 | 4.7 | 10.1 | 6.7 |
iii. 几种化合物的溶解性或溶度积(Ksp)
MnF2 | CaS | MnS | FeS | CuS |
溶于水 | 溶于水 | 2.5×10-13 | 6.3×10-18 | 6.3×10-36 |
(1)研究表明,单质Fe和Fe2+都可以还原MnO2。在硫酸存在的条件下,MnO2将Fe氧化为span>Fe3+的离子方程式是____________。
(2)清液A先用H2O2处理,然后加入CaCO3,反应后溶液的pH≈5。滤渣a的主要成分中有黄铵铁矾NH4Fe3(SO4)2(OH)6。
①H2O2的作用是____________(用离子方程式表示)。
②滤渣a中除了黄铵铁矾,主要成分还有X。用平衡移动原理解释产生x的原因:____________。
(3)用离子方程式表示MnS固体的作用:____________。
(4)滤渣c的成分是____________。
(5)如下图所示装置,用惰性电极电解中性MnSO4溶液可以制得金属Mn。阴极反应有:
i. Mn2++2e-=Mn ii. 2H++2e-=H2↑
电极上H2的产生会引起锰起壳开裂,影响产品质量。
①电解池阳极的电极方程式是________________。
②清液C需要用氨水调节pH=7的原因是____________。
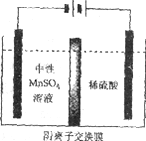
③电解时,中性MnSO4溶液中加入(NH4)2SO4的作用除了增大溶液导电性之外,还有___________(结合电极反应式和离子方程式解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,所含分子数最多的是
A. 22.4L O2(标准状况) B. 1.6 g H2
C. 1.2 mol H2SO4 D. 28g CaO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的说法正确的是( )
A. 化学反应速率可用某时刻生成物的物质的量来表示
B. 在同一反应中,用反应物或生成物浓度变化表示的化学反应速率的值是相等的
C. 化学反应速率是指反应进行的时间内,反应物浓度的减少或生成物浓度的增加
D. 可用单位时间内氢离子物质的量浓度的变化来表示氢氧化钠与硫酸的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA
B. 2.8g乙烯和2.8g聚乙烯中含碳原子数均为0.2NA
C. 6.8g熔融态KHSO4中含有0.1NA个阳离子
D. 常温常压下,17g甲基(-14CH3)所含的中子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学能与其他能量相互转化的说法正确的是( )
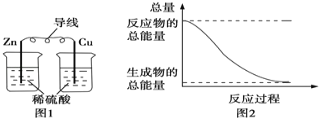
A. 图1所示的装置能将化学能转变为电能
B. 图2所示的反应为吸热反应
C. 中和反应中,反应物的总能量比生成物的总能量低
D. 化学反应中能量变化的主要原因是化学键的断裂与形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向火箭燃料液态联氨(N2H4)中加入催化剂,发生反应:N2H4(l)=N2(g)+2H2(g) △H。
已知: ①3N2H4(l)=4NH3(g)+ N2(g) △H1=-336.6kJ·mol-1
②N2(g)+3H2(g) ![]() 2NH3(g)△H2=-92.4kJ·mol-1。
2NH3(g)△H2=-92.4kJ·mol-1。
下列说法错误的是
A. 使用催化剂后,反应②的正、逆反应的活化能都减小,但△H1不变
B. △H=-151.8kJ·mol-1
C. 将28g N2和10mol H2混合充分反应,放出的热量一定小于92.4 kJ
D. 联氨作为火箭燃料是一种清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. Na与水反应Na+H2O===Na++OH-+H2↑
B. 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
C. 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞SiO2+2OH-==SiO32-+H2O
D. 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++OH-+HCO3-==CaCO3↓+H2O+CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com