
【题目】下列离子方程式书写正确的是( )
A. Na与水反应Na+H2O===Na++OH-+H2↑
B. 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
C. 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞SiO2+2OH-==SiO32-+H2O
D. 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++OH-+HCO3-==CaCO3↓+H2O+CO32-
【答案】C
【解析】
A.原子个数不守恒;
B.氢氧化铁胶体不是沉淀,不能用沉淀符号;
C.二氧化硅为酸性氧化物,能够与氢氧化钠反应生成硅酸钠溶液,硅酸钠具有粘性;
D.氢氧化钠过量,反应生成碳酸钙、碳酸钠和水;
A.Na与水反应生成氢氧化钠和氢气,离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,故B错
Fe(OH)3(胶体)+3H+,故B错
C.二氧化硅为酸性氧化物,能够与氢氧化钠反应生成硅酸钠溶液,离子方程式:SiO2+2OH-═SiO32-+H2O,故C正确;
D.向碳酸氢钙溶液中加入过量的氢氧化钠溶液反应生成碳酸钙、碳酸钠和水,离子方程式:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32-,故D错误;
正确选项C。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,则下列说法正确的是
A. 18gD2O和18gH2O中含有的质子数均为10NA
B. 0.1mol·L-1的NaCl溶液中含有的Na+的数目为0.1NA
C. 11.2LCO2中含有的分子数为0.5NA
D. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于硝酸的认识正确的是( )
A.稀硝酸能使红色石蕊试纸变蓝
B.硝酸能与碳酸钠反应,但不能生成二氧化碳
C.硝酸能与金属反应放出氢气
D.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:

(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是___________________________________。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于_________。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”“不相等”),若实验操作均正确,则所求中和热__________(填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。(从下列选出)
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)实验数据如下表:①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | ||
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=_________。(提示:ΔH=-![]() ,保留一位小数)。
,保留一位小数)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(6)如果用含0.5mol Ba(OH)2的稀溶液与足量稀硫酸溶液反应,反应放出的热____57.3 kJ(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气污染问题日益引起全民关注。
(1)PM 2.5是指大气中直径小于或等于2.5μm(1μm=100nm)的颗粒物。下列说法不正确的是_______(填字母代号)。
a.PM 2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM 2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)北京科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,该新工艺既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2。
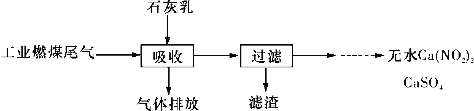
①CaSO4可以调节水泥的硬化时间,尾气中SO2与石灰乳反应生成CaSO4的化学方程式为_______________________________________________________。
②Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式为__________________________________________。
(3)空气中的铅污染可用火焰原子吸收分光光度法分析。已知PbO2在加热过程中发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0% ![]() 的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值。(结果保留一位小数)(要求写出计算过程)。____________
的残留固体,若a点固体表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值。(结果保留一位小数)(要求写出计算过程)。____________
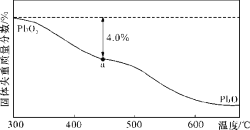 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现榨的苹果汁在空气中会由浅绿色变为棕黄色,你猜测可能的原因是
A.苹果汁中含有Cu2+B.苹果汁中含有OH﹣
C.苹果汁中含有Na+D.苹果汁中的Fe2+变成Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碱金属元素的叙述不正确的是
A.原子最外层都只有1个电子B.随核电荷数增加,原子半径增大
C.在空气中燃烧都生成过氧化物D.随核电荷数增加,与水反应的剧烈程度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中加入一定量的A(s)和B(g),进行如下可逆反应:A(s)+2B(g) ![]() C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是①混合气体的密度②容器内气体的压强③混合气体的总物质的量④C和D的浓度比值⑤B物质的量浓度( )
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是①混合气体的密度②容器内气体的压强③混合气体的总物质的量④C和D的浓度比值⑤B物质的量浓度( )
A. ①⑤B. ③⑤C. ②④D. ①④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com