
【题目】现榨的苹果汁在空气中会由浅绿色变为棕黄色,你猜测可能的原因是
A.苹果汁中含有Cu2+B.苹果汁中含有OH﹣
C.苹果汁中含有Na+D.苹果汁中的Fe2+变成Fe3+
科目:高中化学 来源: 题型:
【题目】关于化学能与其他能量相互转化的说法正确的是( )
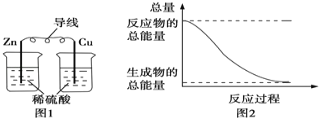
A. 图1所示的装置能将化学能转变为电能
B. 图2所示的反应为吸热反应
C. 中和反应中,反应物的总能量比生成物的总能量低
D. 化学反应中能量变化的主要原因是化学键的断裂与形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使1.0体积的某气态烷烃和烯烃的混合气体在足量空气中完全燃烧,生成2.0体积的二氧化碳和2.2体积的水蒸气(均在120℃、1.01×105Pa条件下测定),则混合气体中烷烃和烯烃的体积比为
A. 2:3 B. 1:4 C. 4:1 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. Na与水反应Na+H2O===Na++OH-+H2↑
B. 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
C. 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞SiO2+2OH-==SiO32-+H2O
D. 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++OH-+HCO3-==CaCO3↓+H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 食用用“瘦肉精”喂养的猪肉对人体无害
B. 塑料袋使用方便,但是会造成“白色污染”,应减少使用
C. 工业废水,生活污水不用处理达标,可随意排放
D. 可以随意抛弃废旧电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200ml含Mg2+、Al3+、NH4+、H+、Cl-的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是

A. x-y=0.01mol B. 原溶液中c(Cl-)=0.75mol·L-1
C. 原溶液的pH=1 D. 原溶液中n(Mg2+):n(Al3+)=5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。

实验步骤:
①在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
②当丙装置中FeC12溶液变黄时,停止加热。
③打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
④在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。
⑤更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为______________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是_________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为______________________________。
(4)有Ⅰ、Ⅱ、Ⅲ三组同学分别完成了上述实验,实验结果如下:
步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |
Ⅰ | 既有Fe3+又有Fe2+ | 有SO42- |
Ⅱ | 有Fe3+无Fe2+ | 有SO42- |
Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
上述实验结果一定能够证明Cl2>Fe3+>SO2的是______(填“I”、“II”或“III”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新能源是解决大气污染的有效途径之一。燃料电池由于能量转化率高.可作为常规能源的替代品而越来越受到关注。
(1)直接甲醇燃料电池(简称DMFC)结构简单、对环境无污染,其工作原理如图所示。
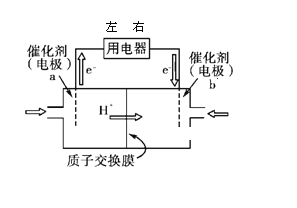
① 外电路电子从用电器_____(填“左端”、或“右端”)进人,b 极电极反应式为______;
② 有1.5mol电子通过用电器,则消耗的甲醇质量为______。
(2)一种用于驱动潜艇的液氨-液氧燃料电池的原理如图所示。
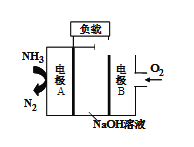
①电极B发生_______(填“氧化”或 “还原”)反应,电池工作时,OH-移向_____(填“A极”或“B极”)。
②电极A的电极反应式为____________。
(3)赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S == 6Cu+SO2↑在该反应中,氧化剂是:___________ 还原剂是:___________ 每当有0.3mol电子通过时,生成的铜的物质的量为 ___________mol 生成的SO2 在标况下的体积为_________ L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,0.3molN2(g)与0.3molH2(g)在体积为1L的密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g),下列示意图合理的是( )
2NH3(g),下列示意图合理的是( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com