
【题目】下列有关碱金属元素的叙述不正确的是
A.原子最外层都只有1个电子B.随核电荷数增加,原子半径增大
C.在空气中燃烧都生成过氧化物D.随核电荷数增加,与水反应的剧烈程度增大
科目:高中化学 来源: 题型:
【题目】向火箭燃料液态联氨(N2H4)中加入催化剂,发生反应:N2H4(l)=N2(g)+2H2(g) △H。
已知: ①3N2H4(l)=4NH3(g)+ N2(g) △H1=-336.6kJ·mol-1
②N2(g)+3H2(g) ![]() 2NH3(g)△H2=-92.4kJ·mol-1。
2NH3(g)△H2=-92.4kJ·mol-1。
下列说法错误的是
A. 使用催化剂后,反应②的正、逆反应的活化能都减小,但△H1不变
B. △H=-151.8kJ·mol-1
C. 将28g N2和10mol H2混合充分反应,放出的热量一定小于92.4 kJ
D. 联氨作为火箭燃料是一种清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. Na与水反应Na+H2O===Na++OH-+H2↑
B. 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
C. 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞SiO2+2OH-==SiO32-+H2O
D. 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++OH-+HCO3-==CaCO3↓+H2O+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200ml含Mg2+、Al3+、NH4+、H+、Cl-的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是

A. x-y=0.01mol B. 原溶液中c(Cl-)=0.75mol·L-1
C. 原溶液的pH=1 D. 原溶液中n(Mg2+):n(Al3+)=5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。

实验步骤:
①在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
②当丙装置中FeC12溶液变黄时,停止加热。
③打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
④在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。
⑤更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为______________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是_________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为______________________________。
(4)有Ⅰ、Ⅱ、Ⅲ三组同学分别完成了上述实验,实验结果如下:
步骤3溶液中含有的离子 | 步骤5溶液中含有的离子 | |
Ⅰ | 既有Fe3+又有Fe2+ | 有SO42- |
Ⅱ | 有Fe3+无Fe2+ | 有SO42- |
Ⅲ | 有Fe3+无Fe2+ | 有Fe2+ |
上述实验结果一定能够证明Cl2>Fe3+>SO2的是______(填“I”、“II”或“III”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 摩尔是国际单位制中的七个物理量之一 B. 0.5 mol H2O中含有的原子数目为1.5NA
C. 64 g氧相当于2 mol氧 D. 1 mol任何物质都约含有6.02×1023个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新能源是解决大气污染的有效途径之一。燃料电池由于能量转化率高.可作为常规能源的替代品而越来越受到关注。
(1)直接甲醇燃料电池(简称DMFC)结构简单、对环境无污染,其工作原理如图所示。
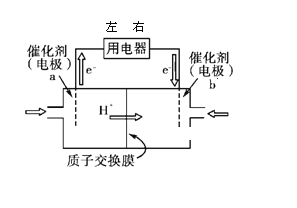
① 外电路电子从用电器_____(填“左端”、或“右端”)进人,b 极电极反应式为______;
② 有1.5mol电子通过用电器,则消耗的甲醇质量为______。
(2)一种用于驱动潜艇的液氨-液氧燃料电池的原理如图所示。
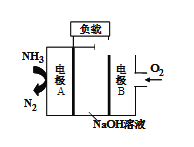
①电极B发生_______(填“氧化”或 “还原”)反应,电池工作时,OH-移向_____(填“A极”或“B极”)。
②电极A的电极反应式为____________。
(3)赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O+Cu2S == 6Cu+SO2↑在该反应中,氧化剂是:___________ 还原剂是:___________ 每当有0.3mol电子通过时,生成的铜的物质的量为 ___________mol 生成的SO2 在标况下的体积为_________ L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,物质的量浓度均为0.1mol·L-1的下列溶液:①CH3COONa ②NaOH ③NaHSO4
④NH4Cl ⑤ NaCl,溶液的pH由大到小的顺序排列正确的是
A. ②>⑤>①>③>④ B. ②>①>⑤>③>④
C. ②>①>⑤>④>③ D. ②>⑤>③>④>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“结晶玫瑰”具有强烈的玫瑰香气,是一种很好的定香剂,其化学名称为“乙酸三氯甲基苯甲酯”,通常以三氯甲基苯基甲醇和醋酸酐为原料制备:
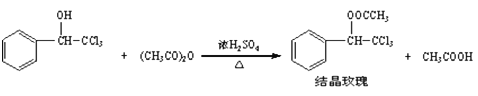
已知:

操作步骤如下:
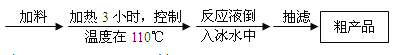
请根据以上信息,回答下列问题:
(1)加料时,应先加入三氯甲基苯基甲醇和酷酸酐,然后慢慢加入浓硫酸并______,待混合均匀后,最适宜的加热方式为______(填“水浴加热”或“油浴加热”)。
(2)粗产品的成分是结晶攻瑰与少量_______(填名称)的混合物,设计了如下方案进行提纯和检验。请完成表中内容:
序号 | 实验方案 | 实验现象 | 结论 |
① | 将粗产品溶解在中,按粗产品、溶剂的质量比为1:__混合,用水浴加热到70℃回流溶剂使粗产品充分溶解 | 得到无色溶液 | |
② | 将步骤1所得溶液____________抽滤 | 得到白色晶体 | |
③ | 干燥步骤2所得白色晶体,____________ | _____________ | 白色晶体是结晶玫瑰 |
(3)4.51g三氯甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰4.68g,则产率是________(小数点后保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com