
【题目】常温下,物质的量浓度均为0.1mol·L-1的下列溶液:①CH3COONa ②NaOH ③NaHSO4
④NH4Cl ⑤ NaCl,溶液的pH由大到小的顺序排列正确的是
A. ②>⑤>①>③>④ B. ②>①>⑤>③>④
C. ②>①>⑤>④>③ D. ②>⑤>③>④>①
科目:高中化学 来源: 题型:
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:

(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是___________________________________。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于_________。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”“不相等”),若实验操作均正确,则所求中和热__________(填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。(从下列选出)
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)实验数据如下表:①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | ||
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=_________。(提示:ΔH=-![]() ,保留一位小数)。
,保留一位小数)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(6)如果用含0.5mol Ba(OH)2的稀溶液与足量稀硫酸溶液反应,反应放出的热____57.3 kJ(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碱金属元素的叙述不正确的是
A.原子最外层都只有1个电子B.随核电荷数增加,原子半径增大
C.在空气中燃烧都生成过氧化物D.随核电荷数增加,与水反应的剧烈程度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷的球棍模型如图所示,下列有关说法不正确的是
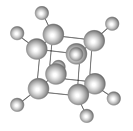
A. 其一氯代物只有一种
B. 其二氯代物有三种同分异构体
C. 它与苯乙烯( C6H4-CH=CH2)互为同分异构体
D. 它与2,3,5-三甲基一3-乙基己烷互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为可逆反应A(s)+3B(g) ![]() 2C(g)+2D(g)在不同条件下的化学反应速率,其中表示速率最快的是( )
2C(g)+2D(g)在不同条件下的化学反应速率,其中表示速率最快的是( )
A. υ(A)=0.5mol·L-1·min-1B. υ(B)=0.020mol·L-1·s-1
C. υ(C)=0.4mol·L-1·min-1D. υ(D)=0.015mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用右图所示装置制备乙酸乙酯。实验如下:
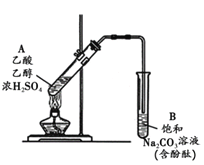
① 向浓H2SO4乙醇混合液中滴入乙酸后,加热试管A
② 一段时间后,试管B中红色溶液上方出现油状液体
③ 停止加热,振荡试管B,油状液体层变薄,下层红色溶液褪色
④ 取下层褪色后的溶液,滴入酚酞后又出现红色
结合上述实验,下列说法正确的是
A. ①中加热利于加快酯化反应速率,故温度越高越好
B. ③中油状液体层变薄主要是乙酸乙酯溶于Na2CO3溶液所致
C. ③中红色褪去的原因可能是酚酞溶于乙酸乙酯中
D. 取②中上层油状液体测其,共有3组峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积恒定的密闭容器中加入一定量的A(s)和B(g),进行如下可逆反应:A(s)+2B(g) ![]() C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是①混合气体的密度②容器内气体的压强③混合气体的总物质的量④C和D的浓度比值⑤B物质的量浓度( )
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是①混合气体的密度②容器内气体的压强③混合气体的总物质的量④C和D的浓度比值⑤B物质的量浓度( )
A. ①⑤B. ③⑤C. ②④D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)有多种化合物.在高压条件下.采用钴碘催化循环法制备醋酸过程如图所示。
(1)一种锂钴复合氧化物晶体的结构如图所示,其化学式为___________。

(2)下图表示的总反应的化学方程式为______________________。
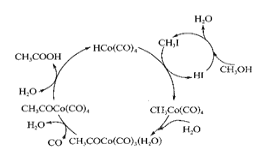
(3)基态Co原子的价电子排布图为______________。
(4)1个CH3COCo(CO)4分子中含有![]() 键的数目为______。与CO32—互为等电子体的一种分子的化学式为______________。
键的数目为______。与CO32—互为等电子体的一种分子的化学式为______________。
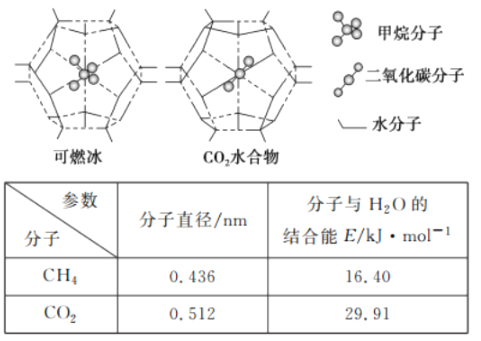
(5)CH4、CO2是合成CH3OH的基本原料。一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。 CH4与H2O形成的水合物晶体.俗称“可燃冰”。为开采深海海底的“可燃冰’,有科学家提出用以CO2换CH4的设想。已知下图中笼状结构的空腔直径为0.586 nm.结合图表从物质结构及性质的角度分析,该设想的依据是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为VL的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
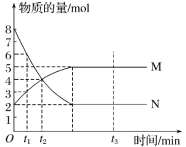
(1)此反应的化学方程式中![]() =____。
=____。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为_____。
(3)下列叙述能说明上述反应达到平衡状态的是____(填字母)。
A 反应中M与N的物质的量之比为1∶1
B 混合气体的总质量不随时间的变化而变化
C 混合气体的总物质的量不随时间的变化而变化
D 单位时间内消耗a mol N,同时生成b mol M
E 混合气体的压强不随时间的变化而变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com