
【题目】锰是一种非常重要的金属元素,在很多领域有着广泛的应用。利用废铁屑还原浸出低品位软锰矿制备硫酸锰,然后进行电解,是制备金属锰的新工艺,其流程简图如下:
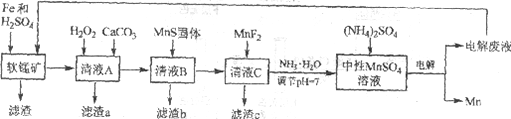
已知:
i. 低品位软锰矿主要成份有MnO2、Al2O3、Fe2O3、Cu2(OH)2CO3、CaCO3、SiO2等。
ii. 部分金属离子以氢氧化物沉淀时的pH
Fe2+ | Fe3+ | Al3+ | Mn2+ | Cu2+ | |
开始沉淀的pH | 6.8 | 1.8 | 3.7 | 8.6 | 5.2 |
沉淀完全的pH | 8.3 | 2.8 | 4.7 | 10.1 | 6.7 |
iii. 几种化合物的溶解性或溶度积(Ksp)
MnF2 | CaS | MnS | FeS | CuS |
溶于水 | 溶于水 | 2.5×10-13 | 6.3×10-18 | 6.3×10-36 |
(1)研究表明,单质Fe和Fe2+都可以还原MnO2。在硫酸存在的条件下,MnO2将Fe氧化为span>Fe3+的离子方程式是____________。
(2)清液A先用H2O2处理,然后加入CaCO3,反应后溶液的pH≈5。滤渣a的主要成分中有黄铵铁矾NH4Fe3(SO4)2(OH)6。
①H2O2的作用是____________(用离子方程式表示)。
②滤渣a中除了黄铵铁矾,主要成分还有X。用平衡移动原理解释产生x的原因:____________。
(3)用离子方程式表示MnS固体的作用:____________。
(4)滤渣c的成分是____________。
(5)如下图所示装置,用惰性电极电解中性MnSO4溶液可以制得金属Mn。阴极反应有:
i. Mn2++2e-=Mn ii. 2H++2e-=H2↑
电极上H2的产生会引起锰起壳开裂,影响产品质量。
①电解池阳极的电极方程式是________________。
②清液C需要用氨水调节pH=7的原因是____________。
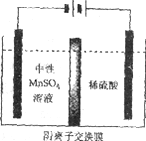
③电解时,中性MnSO4溶液中加入(NH4)2SO4的作用除了增大溶液导电性之外,还有___________(结合电极反应式和离子方程式解释)。
【答案】3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O 2Fe2++H2O2+2H+=2Fe3++2H2O Al3++3H2O ![]() Al(OH)3+3H+,加入碳酸钙,消耗H+,H+浓度降低,平衡向右移动,最终生成Al(OH)3 MnS(s)+Cu2+=Mn2++ CuS(s) CaF2 2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O) 降低c(H+),减弱H+的放电趋势(放电能力),使阴极上产生的H2减少 阴极2H2O+2e-=H2+2OH-,NH4++OH-=NH3·H2O,防止溶液中因为pH过大而产生Mn(OH)2
Al(OH)3+3H+,加入碳酸钙,消耗H+,H+浓度降低,平衡向右移动,最终生成Al(OH)3 MnS(s)+Cu2+=Mn2++ CuS(s) CaF2 2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O) 降低c(H+),减弱H+的放电趋势(放电能力),使阴极上产生的H2减少 阴极2H2O+2e-=H2+2OH-,NH4++OH-=NH3·H2O,防止溶液中因为pH过大而产生Mn(OH)2
【解析】
由流程图可知,软锰矿加入Fe和H2SO4,MnO2将Fe氧化为Fe3+,本身被还原为Mn2+,经过滤除去不溶的SiO2。清液A中含有Mn2+、Fe2+、Fe3+、Al3+、Cu2+和Ca2+等离子,在清液A中加入H2O2可将Fe2+氧化为Fe3+,加入碳酸钙调节溶液的pH,产生黄铵铁矾NH4Fe3(SO4)2(OH)6和氢氧化铝沉淀,除去Fe2+、Fe3+、Al3+。清液B中含有Mn2+、Cu2+和Ca2+等离子,在清液B中加入MnS固体,生成CuS沉淀,除去Cu2+。清液C中含有Mn2+和Ca2+等离子,在清液C中加入MnF2可将Ca2+转化为CaF2沉淀而除去。最后加氨水调节溶液pH=7,电解中性MnSO4溶液制取Mn,以此分析。
(1)根据以上分析,在硫酸存在的条件下,MnO2将Fe氧化为Fe3+,本身被还原为Mn2+,根据得失电子守恒,离子方程式是3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O。
故答案为:3MnO2+2Fe+12H+=3Mn2++2Fe3++6H2O;
(2) ①黄铵铁矾NH4Fe3(SO4)2(OH)6中的铁为+3价,所以H2O2的作用是将Fe2+氧化为Fe3+,
离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②分析流程图可知,滤渣a中除了黄铵铁矾,主要成分还有Al(OH)3。产生Al(OH)3的原因是Al3++3H2O ![]() Al(OH)3+3H+,加入碳酸钙,消耗H+,H+浓度降低,平衡向右移动,最终生成Al(OH)3。
Al(OH)3+3H+,加入碳酸钙,消耗H+,H+浓度降低,平衡向右移动,最终生成Al(OH)3。
故答案为:Al3++3H2O ![]() Al(OH)3+3H+,加入碳酸钙,消耗H+,H+浓度降低,平衡向右移动,最终生成Al(OH)3
Al(OH)3+3H+,加入碳酸钙,消耗H+,H+浓度降低,平衡向右移动,最终生成Al(OH)3
(3) 分析流程图可知,加入MnS固体,生成CuS沉淀,发生沉淀转化,除去Cu2+,离子方程式为:MnS(s)+Cu2+=Mn2++ CuS(s)。
故答案为:MnS(s)+Cu2+=Mn2++ CuS(s);
(4) 在清液C
故答案为:CaF2;
(5)①用惰性电极电解中性MnSO4溶液,电解池阳极发生氧化反应,电极方程式是2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O)。
故答案为:2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O)
②根据信息,电极上H2的产生会引起锰起壳开裂,影响产品质量,所以清液C需要用氨水调节pH=7,降低c(H+),减弱H+的放电趋势(放电能力),使阴极上产生的H2减少。
故答案为:降低c(H+),减弱H+的放电趋势(放电能力),使阴极上产生的H2减少;
③电解时,阴极发生2H2O+2e-=H2+2OH-,NH4++OH-=NH3·H2O,为防止溶液中因为pH过大而产生Mn(OH)2,则加入(NH4)2SO4控制pH不过大。
故答案为:阴极2H2O+2e-=H2+2OH-,NH4++OH-=NH3·H2O,防止溶液中因为pH过大而产生Mn(OH)2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期的主族元素,其原子序数依次增大,A的原子电子层数等于其核外电子数,B与C可形成离子化合物CB2,D原子的M层电子数是K层电子数的3倍。
(1)写出A的简单阴离子的电子式是________。
(2)E的氢化物与C单质相比,沸点较低的是_________(填化学式)。
(3)C、E组成的化合物所含化学键的类型是______________。
(4)B、D、E按原子半径由大到小的顺序排列为_____________(填元素符号)。
(5)E的最高价氧化物对应的水化物化学式是____________
(6)若D和E可组成化合物D2E2 ,在该化合物中各原子最外层均达到8电子稳定结构,写出其结构式__________________
(7)写出E在元素周期表中的位置____________________________________。
(8)将D的最高价含氧酸的浓溶液露置空气中,质量会发生变化,体现了其对应酸的_____________性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收,其中Y是单质。
SO 2(g) + 2CO(g)![]() 2X(g)+Y(l)
2X(g)+Y(l)
为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(SO2)/mol·L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
c(CO)/mol·L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
下列说法不正确的是
A. X的化学式为CO2
B. 前1s内v(X)=" 1.00" mol·L-1·s-1
C. 该回收原理运用了SO2的还原性
D. 该温度下,此反应的平衡常数的数值是3.33×1036
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL 0.1 mol·L-1 NH4HSO4溶液中逐滴滴入0.1 mol·L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如右图所示:
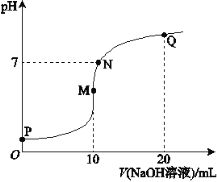
(1)用电离方程式表示P点pH<7的原因是________。
(2)M、Q两点中,水的电离程度较大的是________点。
(3)下列关系中,正确的是________。
a.M点c(Na+)>c(NH4+)
b.N点c(NH4+)+c(Na+)=2c(SO42-)
c.Q点c(NH4+)+c(NH3·H2O)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,则下列说法正确的是
A. 18gD2O和18gH2O中含有的质子数均为10NA
B. 0.1mol·L-1的NaCl溶液中含有的Na+的数目为0.1NA
C. 11.2LCO2中含有的分子数为0.5NA
D. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于硝酸的认识正确的是( )
A.稀硝酸能使红色石蕊试纸变蓝
B.硝酸能与碳酸钠反应,但不能生成二氧化碳
C.硝酸能与金属反应放出氢气
D.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com