
(16分)“向海洋进军”,已成为世界许多国家发展的战略口号,海水中通常含有较多的Ca2+、Mg2+、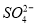 等杂质离子,以海盐为原料的氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
等杂质离子,以海盐为原料的氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
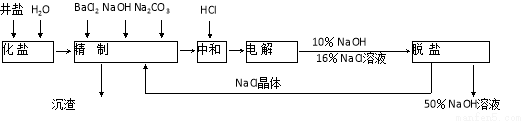
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极的电极反应式为 ;
(2)电解过程的总反应的化学方程式_________________________________________。
(3)电解槽阳极产物可用于_____________________________(至少写出两种用途)。
(4)工业食盐含Ca2+、Mg2+等杂质,精制过程中除去这2种离子所发生反应的离子方程式为: 。
(5)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(6)为了有效除去Ca2+、Mg2+、SO42-加入试剂的合理顺序为
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(7)已知NaOH、NaCl在水中的溶解度数据如下表:
温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
NaOH /g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
NaCl/ g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
根据上述数据,脱盐工序中利用通过 、 (填操作名称)除去NaCl。
31. (16分)(1)2Cl--2e-=Cl2↑(2分)
(2)2NaCl + 2H2O  2NaOH + H2↑+ Cl2↑(2分)
2NaOH + H2↑+ Cl2↑(2分)
(3)制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种)(2分)
(4)Ca2++CO32-= CaCO3↓,(2分) Mg2++2OH-=Mg(OH)2↓(2分)
(5)a、c (2分) (6)b、c (2分) (7)蒸发结晶、趁热过滤;(2分)
【解析】
试题分析:(1)与电源正极相连的电极为阳极,溶液中的阴离子(Cl- OH-)Cl-优先放电,电极反应为:2Cl--2e-=Cl2↑;(2)饱和食盐水中阴阳离子分别为:Cl- 、OH-、 Na+、 H+,通电后,Cl-、 H+ 优先放电生成氯气和氢气,因此电解过程的总反应为2NaCl + 2H2O  2NaOH + H2↑+ Cl2↑(3)阳极产物为氯气,实际上考察氯气的用途:制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等,根据要求写;(4)精制的过程中加入了NaOH 、Na2CO3 所以离子方程式为Ca2++CO32-= CaCO3↓, Mg2++2OH-=Mg(OH)2↓(5)为了防止引入新的杂质,只能加入BaCl2或Ba(OH)2,Cl-不属于杂质离子,OH-最后通过滴加适量的盐酸除去;(6)物质提纯中依次除杂的原则是:先加的除杂试剂要过量,后加入的除杂试剂不仅能除去原有的杂质离子也能除去新进入的杂质离子,所以粗盐精制的要求是①除去SO42-要在除去Ca2+之前,②最后用盐酸调溶液至中性,所以方法有多种。(7)当两种物质都可溶,但溶解度随温度变化差异较大时,常用结晶的方法
2NaOH + H2↑+ Cl2↑(3)阳极产物为氯气,实际上考察氯气的用途:制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等,根据要求写;(4)精制的过程中加入了NaOH 、Na2CO3 所以离子方程式为Ca2++CO32-= CaCO3↓, Mg2++2OH-=Mg(OH)2↓(5)为了防止引入新的杂质,只能加入BaCl2或Ba(OH)2,Cl-不属于杂质离子,OH-最后通过滴加适量的盐酸除去;(6)物质提纯中依次除杂的原则是:先加的除杂试剂要过量,后加入的除杂试剂不仅能除去原有的杂质离子也能除去新进入的杂质离子,所以粗盐精制的要求是①除去SO42-要在除去Ca2+之前,②最后用盐酸调溶液至中性,所以方法有多种。(7)当两种物质都可溶,但溶解度随温度变化差异较大时,常用结晶的方法
考点:考察电解原理的应用;物质的用途;物质的除杂;离子方程式的书写等知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
下列与含氯化合物有关的说法正确的是
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.氯化铝溶液中加入过量的氨水:Al3++4 NH3·H2O=AlO2-+4 NH4+
B.稀硝酸中加入过量铁粉:Fe+4H++NO3- = Fe3++NO↑+2H2O
C.二氧化锰与浓盐酸混合加热:MnO2+4H++2Cl- △ Mn2++ Cl2↑+2H2O
D.石灰水中加入过量小苏打溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2015届广西桂林市高三上学期第一次月考化学试卷(解析版) 题型:选择题
某反应体系中存在下列六种物质:As2S3、HNO3、H2SO4、NO、H3AsO4和H2O,已知其中As2S3是反应物之一。下列说法不正确的是
A、该反应属于氧化还原反应
B、此反应中只有砷元素被氧化,只有氮元素被还原
C、HNO3、H2O是反应物,H2SO4、NO、H3AsO4是生成物
D、HNO3、H2SO4、H3AsO4都是最高价氧化物对应的水化物
查看答案和解析>>
科目:高中化学 来源:2015届广东肇庆中学高三8月考理综化学试卷(解析版) 题型:选择题
下列实验能达到目的的是
A.用浓FeCl3溶液和NaOH溶液混合制备Fe(OH)3胶体
B.将混有少量HCl的CO2通入饱和NaHCO3溶液中除去HCl
C.测定等浓度的Na2CO3和Na2SO3 溶液的pH大小,可比较非金属性: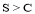
D.用AgNO3溶液鉴别Na2SO4溶液与NaCl溶液
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
(16分)化工工业中常用乙苯脱氢的方法制备苯乙烯。已知某温度下:
反应①:CO2(g)+H2(g) CO(g)+H2O(g),ΔH= +41.2 kJ/mol;
CO(g)+H2O(g),ΔH= +41.2 kJ/mol;
反应②: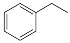 (g)
(g)
 (g)+H2(g),ΔH= +117.6 kJ/mol。
(g)+H2(g),ΔH= +117.6 kJ/mol。
①、②的化学反应平衡常数分别为K1、K2。
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 。该反应的化学平衡常数K= (用K1、K2表示)。
(2)恒温恒容条件下,反应①达到平衡后,t1时刻通入少量CO2。请
画出t1之后的正逆反应曲线,并作出标注。
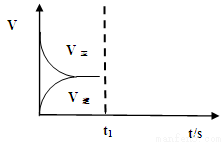
(3)已知某温度下,Ag2SO4饱和溶液中c(Ag+)=0.04 mol/L,则该温度
下Ksp(Ag2SO4)= 。(保留两位有效数字)
(4)电解法制备高铁酸钠(Na2FeO4),总反应式为:Fe+2H2O+2OH-=FeO42-+3H2↑,电解质溶液选用NaOH溶液。该电解池阳极材料是 (写化学式);阳极的电极反应式为__ _________。
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三8月月考化学试卷(解析版) 题型:选择题
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| 操作 | 现象 | 结论 |
A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市海珠区高三8月摸底考试理综化学试卷(解析版) 题型:填空题
(16分)二氧化钛(TiO2)又称钛白,工业上利用钛铁矿(主要成分FeTiO3,其中铁为正二价)为原料,采用硫酸法制得,其工艺流程如下图所示
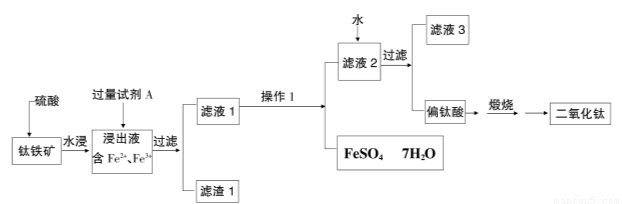
请回答:
(1)铁矿加入硫酸反应可制得硫酸氧钛,其反应的化学方程式为:
FeTiO3+ 2H2SO4=( )TiOSO4+( )+( );
(2)为了提高二氧化钛的纯度,需要除去浸出液中的Fe3+,则加入的试剂A为 ,需过量的原因是 。
(3)操作1是 。
(4)进行操作1时需将滤液1在70-75℃,压力8000Pa的条件下真空蒸发器中进行,其原因是为了防止 ,滤液2加水稀释使硫酸氧钛(TiOSO4)水解生成偏钛酸(TiO2·nH2O),请写出该水解反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com