
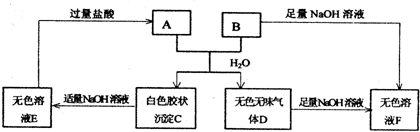
 由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.
由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.

 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通 入淀粉KI溶液 |
溶液最初变成 蓝 蓝 色 |
Cl2+2I-=2Cl-+I2 Cl2+2I-=2Cl-+I2 (用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=10HCl+2HIO3 5Cl2+I2+6H2O=10HCl+2HIO3 (用化学方程式表示) |
| 9g |
| 18g/mol |
| 40g |
| 80g/mol |
 ;故答案为:
;故答案为:
| ||


科目:高中化学 来源: 题型:



| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
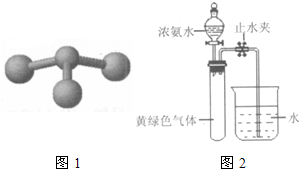 (2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁
(2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁

| ||
| ||
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.
甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
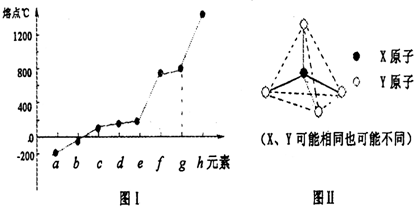
| 氢化物 | 沸点℃ |
| A | 1317 |
| B | 100 |
| C | 19.5 |
| D | -33 |
| E | -162 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com