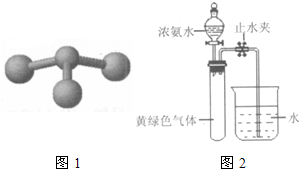
(2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁
(1)转化关系中所涉及的反应为非氧化还原反应,且乙为水.
①若甲为块状固体,丙为可燃性气体,其分子内既含有极性键又含有非极性键.则丙的电子式是
.
②若甲是由N和Cl元素组成的化合物,其分子结构模型
如图1所示,丙具有漂白性.则甲中Cl元素的化合价是
+1
+1
.
(2)转化关系中所涉及的反应为氧化还原反应,且乙为水.
①若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,此反应的离子方程式是
2Na+2H2O=2Na++2OH-+H2↑
2Na+2H2O=2Na++2OH-+H2↑
.
②若丙和丁都可在一定条件下还原CuO,此反应的化学方程式是
.
③若甲是由N和O元素组成的气态物质,呈红棕色.将3.36g Fe加到一定量丙溶液中,收集到1.12L气体丁(已折算为标准状况),则反应的离子方程式是
6Fe+20HNO3=3Fe(NO3)2+3Fe(NO3)3+5NO+10H2O
6Fe+20HNO3=3Fe(NO3)2+3Fe(NO3)3+5NO+10H2O
.
(3)Hofmann依据上述转化关系测定氨分子的组成.现用如图2所示的装置进行实验,打开分液漏斗的活塞,滴下浓氨水,至不再反应为止;关闭分液漏斗的活塞,待恢复到室温,打开止水夹,试管内液面上升至
处.
①滴下浓氨水一段时间后,试管内发生反应的化学方程式是
8NH3+3C12=N2+6NH4Cl
8NH3+3C12=N2+6NH4Cl
.
②证明试管内“不再反应”的实验操作和现象是
待产生的大量白烟沉降后,继续滴加浓氨水,不再产生白烟
待产生的大量白烟沉降后,继续滴加浓氨水,不再产生白烟
.

 (2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁
(2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁

 ,
, ;
; 

 (2010?西城区一模)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
(2010?西城区一模)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.




 (R、R'代表烃基或氢原子)
(R、R'代表烃基或氢原子)






 )的合成路线:
)的合成路线:


