
| c(b-a) |
| 25 |
| c(b-a) |
| 25 |
| 16c(b-a) |
| m |
| 16c(b-a) |
| m |
| c×(b-a)×10-3mol |
| 0.025L |
| c(b-a) |
| 25 |
| c(b-a) |
| 25 |
| ||
| m |
| 16c(b-a) |
| m |
| c(b-a) |
| 25 |
| 16c(b-a) |
| m |


科目:高中化学 来源: 题型:
(1)第一组同学称取样品m
①为完成测定,以下图示中还缺少的仪器名称是_______________________。
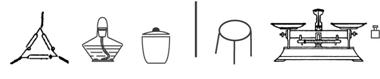
②为了减少实验误差,在加热至恒重的过程中应如何操作。
___________________________________________________________________。
③若坩埚质量为m
(2)第二组同学称取样品m g,设计了如下图所示的装置:
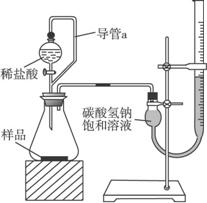
①装置中导管a的作用是________________________________________________________。
②实验结束时,该组同学在测量实验中生成气体体积时应注意哪些问题?
____________________________________________________________________
____________________________________________________________________。
(3)分析上述两组实验方案,你认为哪组实验方案的误差会小些。
____________________________________________________________________。
(4)请你设计一种除上述实验原理以外的方案,写出反应的化学方程式。
____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三10月月考化学试卷 题型:实验题
(12分)有一包含有碳酸钠杂质的碳酸氢钠样品。为了测定其纯度,某校同学在实验室进行如下实验。甲组实验方案:
在坩埚中称取样品3.0g →加热→冷却→称量→再加热•…(至恒重)。
①完成上述实验应该用到的玻璃仪器除酒精灯外还有____ ____。
②若坩埚质量为16.0g,加热至恒重时坩埚和残留物总质量为18.2g,则样品的纯度为 _
(1)乙组:称取样品,利用下面的部分装置测得室温下样品与酸反应放出CO2的体积,计算样品的纯度(已知碳酸钠、碳酸氢钠与酸的反应都是放热反应)。

①完成该实验方案应选择的最佳装置是 __(用字母回答,下同)。
②该实验应选用的酸是_ _
a.稀盐酸 b.稀硫酸 c.稀硝酸 d.三种酸均可。理由是________________________
(2) 丙组中A同学根据
 的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
B同学对该实验方案提出质疑,丙组同学查阅了相关资料,并进行了如下实验:
室温下,取20 mL0.4 mol/L NaHCO3溶液置于烧杯中,向其中加入20 mL 2 mol/L CaCl2溶液,用玻璃棒搅拌。烧杯中出现白色沉淀,还有气泡产生。产生该现象的原因是_________ __ ___ (用有关离子方程式解释)。[来源:Z,xx,k.Com]
由此丙组同学共同讨论,否定了 A同学的设计方案。
查看答案和解析>>
科目:高中化学 来源: 题型:
(15 分)
有一包含有碳酸钠杂质的碳酸氢钠样品。为了测定其纯度,某校同学在实验室进行如下实验。甲组实验方案:在坩埚中称取样品3.0g→加热→冷却→称量→再加热??…"(至恒重)。
①完成上述实验应该用到的玻璃仪器除酒精灯外还有________。
②若坩埚质量为16.0g,加热至恒重时坩埚和残留物总质量为18.2g,则样品的纯度为____
(1) 乙组:称取样品,利用下面的部分装置测得室温下样品与酸反应放出CO2的体积,计算样品的纯度(已知碳酸钠、碳酸氢钠与酸的反应都是放热反应)。

①完成该实验方案应选择的最佳装置是________(用字母回答,下同)。
②该实验应选用的酸是________
a.稀盐酸 b.稀硫酸 c.稀硝酸 d.三种酸均可
理由是________________________
(2)丙组中A同学根据![]() 的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反运后过滤→洗涤干燥称量→计算纯度。B同学对该实验方案提出质疑,丙组同学查阅了相关资料并进行了如下实验:
的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反运后过滤→洗涤干燥称量→计算纯度。B同学对该实验方案提出质疑,丙组同学查阅了相关资料并进行了如下实验:
室温下,取20 mL0.4 mol/L NaHCO3溶液置于烧杯中,向其中加入20 mL 2 mol/L CaCl2溶液,用玻璃棒搅拌。烧杯中出现白色沉淀,还有气泡产生。产生该现象的原因是______________(用有关离子方程式解释)。
由此丙组同学共同讨论,否定了 A同学的设计方案。
查看答案和解析>>
科目:高中化学 来源:2012届浙江省慈溪中学高三10月月考化学试卷 题型:实验题
(12分)有一包含有碳酸钠杂质的碳酸氢钠样品。为了测定其纯度,某校同学在实验室进行如下实验。甲组实验方案:
在坩埚中称取样品3.0g →加热→冷却→称量→再加热?…(至恒重)。
①完成上述实验应该用到的玻璃仪器除酒精灯外还有____ ____。
②若坩埚质量为16.0g,加热至恒重时坩埚和残留物总质量为18.2g,则样品的纯度为 _
(1)乙组:称取样品,利用下面的部分装置测得室温下样品与酸反应放出CO2的体积,计算样品的纯度(已知碳酸钠、碳酸氢钠与酸的反应都是放热反应)。
①完成该实验方案应选择的最佳装置是 __(用字母回答,下同)。
②该实验应选用的酸是_ _
a.稀盐酸b.稀硫酸c.稀硝酸d.三种酸均可。理由是________________________
(2) 丙组中A同学根据 的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
B同学对该实验方案提出质疑,丙组同学查阅了相关资料,并进行了如下实验:
室温下,取20 mL0.4 mol/L NaHCO3溶液置于烧杯中,向其中加入20 mL 2 mol/L CaCl2溶液,用玻璃棒搅拌。烧杯中出现白色沉淀,还有气泡产生。产生该现象的原因是_________ __ ___ (用有关离子方程式解释)。[来源:Z,xx,k.Com]
由此丙组同学共同讨论,否定了A同学的设计方案。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com