
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置 (夹持装置已略)如图所示:下列说法错误的是( )
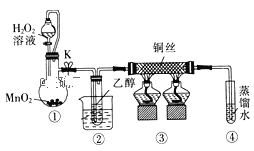
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出,再停止加热
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的叙述正确的是( )
A.糖类、油脂、蛋白质都是有机高分子化合物
B.有机物![]() 可以发生消去反应和催化氧化
可以发生消去反应和催化氧化
C.乙醇可以和金属钠反应很缓慢地放出氢气,说明乙醇的酸性很弱
D.福尔马林可用作食品防腐剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
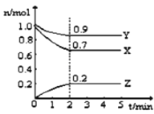
(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2 、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率 v(N2) = __________,250s时,H2的转化率为____________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___(填“吸收”或“放出”)的能量为____, 反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___(填“吸收”或“放出”)的能量为____, 反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
(4)反应达平衡时容器内混合气体的平均相对分子质量比起始时____(填增大、减小或不变),混合气体密度比起始时______(填增大、减小或不变)。
(5)为加快反应速率,可以采取的措施是_______
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活中有广泛应用。
(1)Fe3+基态核外电子排布式为______。
(2)实验室用KSCN溶液、苯酚检验Fe3+。
①1mol苯酚分子中含有σ键的数目为______。
②类卤素离子![]() 可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸
可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸![]() 和异硫氰酸
和异硫氰酸![]() ,这两种酸中沸点较高的是______
,这两种酸中沸点较高的是______
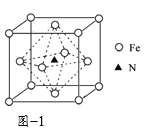
(3)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为______。
(4)某铁的化合物结构简式如图2所示
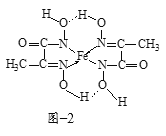
①上述化合物中所含有的非金属元素的电负性由大到小的顺序为______(用元素符号表示)。
②上述化合物中氮原子的杂化方式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如右图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 四种元素的单质中,Z单质的熔、沸点最低
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用浓度为![]() 的盐酸分别逐滴加入到
的盐酸分别逐滴加入到![]() 的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是
的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示.下列说法正确的是![]()
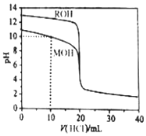
A.![]() 时,溶液中微粒浓度的关系是:
时,溶液中微粒浓度的关系是:![]()
B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,溶液中离子浓度的关系是:![]()
C.![]() 时,溶液中微粒浓度的关系是:
时,溶液中微粒浓度的关系是:![]()
D.![]() 时,不可能存在:
时,不可能存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如下:
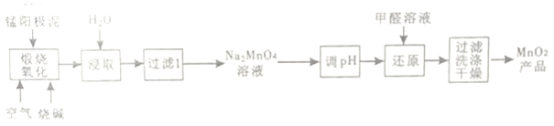
(1)“煅烧氧化”时,1mol MnO煅烧完全转化为Na2MnO4失去电子的物质的量为___________;MnO2煅烧反应的化学方程式为__________________。
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有____________、____________(列举2点)
(3)“调pH”是将溶液pH 调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应,生成MnO2和___________;写出用pH试纸测定溶液pH的操作_______________。
(4)“还原”时有无机含氧酸盐生成,发生反应的化学方程式为_____________。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1. 准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2. 然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是_____________;产品中MnO2的质量分数为ω(MnO2)=____________(列出计算的表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH值得盐酸和醋酸溶液分别加水稀释。pH值随溶液体积变化变化如图所示。据图判断正确的是()
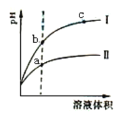
A.Ⅱ为盐酸稀释时pH值变化曲线
B.b点酸的总浓度小于a点酸的总浓度
C.两种酸的物质的量浓度一定相等
D.a点Kw的数值比b点Kw的数值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种新型液硫二次电池,其工作原理如图所示。下列说法错误的是

A. 放电时,电池左侧为负极,发生氧化反应
B. 充电时,电解质溶液中K+经交换膜向右侧移动
C. 放电时,电池右侧的电极反应为I3-+2e-=3I-
D. 充电时,电池的总反应为S22-+3I-![]() 2S2-+I3-
2S2-+I3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com