
【题目】我国科学家研发了一种新型液硫二次电池,其工作原理如图所示。下列说法错误的是

A. 放电时,电池左侧为负极,发生氧化反应
B. 充电时,电解质溶液中K+经交换膜向右侧移动
C. 放电时,电池右侧的电极反应为I3-+2e-=3I-
D. 充电时,电池的总反应为S22-+3I-![]() 2S2-+I3-
2S2-+I3-
【答案】B
【解析】
由图可知,新型液硫二次电池放电时,电池左侧为负极,S2-在负极上放电发生氧化反应生成S22-,电极反应式为2S2-—2e-= S22-,电池右侧为正极,I3-在正极上放电发生还原反应生成I-,电极反应式为I3-+2e-=3I-,充电时,原电池的负极为电解池的阴极,正极为阳极。
A项、放电时,电池左侧为负极,S2-在负极上放电发生氧化反应生成S22-,故A正确;
B项、充电时,阳离子向阴极移动,电池左侧为阴极,K+经交换膜向左侧移动,故B错误;
C项、放电时,电池右侧为正极,I3-在正极上放电发生还原反应生成I-,电极反应为I3-+2e-=3I-,故C正确;
D项、放电时电池的总反应为2S2-+I3-=S22-+3I-,则充电时电池的总反应为S22-+3I-![]() 2S2-+I3-,故D正确。
2S2-+I3-,故D正确。
故选B。


科目:高中化学 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置 (夹持装置已略)如图所示:下列说法错误的是( )
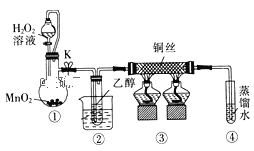
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出,再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两个装置中,液体体积均为200mL,开始时电解质溶液的浓度均为0.1 mol/L,工作一段时间后,测得导线上都通过了0.02 mol电子,若不考虑溶液体积的变化,下列叙述中正确的是()
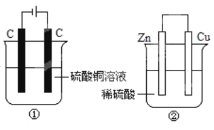
A.产生气体体积①=②
B.溶液的pH变化:①减小②增大
C.电极上析出固体质量①<②
D.电极反应式:①中阳极Cu2++2e—=Cu,②中负极Zn—2e—=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
C.一定条件下,反应N2+3H2![]() 2NH3达到平衡时,3v正(H2)=2v逆(NH3)
2NH3达到平衡时,3v正(H2)=2v逆(NH3)
D.反应2NO(g)+2CO(g)===N2(g)+2CO2(g)常温下可自发进行,该反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) H1=-393.5kJ·mol-1
CO2(g)+C(s)=2CO(g) H2=+172.5kJ·mol-1
S(s)+O2(g)=SO2(g) H3=-296.0kJ·mol-1
写出CO除SO2的热化学方程式_______。
(2)某同学想利用下图装置验证同主族元素非金属性的变化规律。
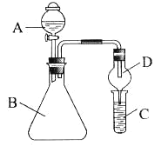
①若要证明非金属性Cl>I,则在A 中加浓盐酸,B中加KMnO4固体,C中加入淀粉碘化钾溶液,观察到C中溶液_____的现象,即可证明。从环境保护的观点考虑,此装置的缺点是_____。
②若要证明非金属性C>Si,则在A 中加盐酸,B中加CaCO3固体,C中加_____(写化学式)溶液。该同学认为若观察到C中溶液有白色沉淀生成,即可证明,该方案存在明显缺陷,可通过在两装置间添加装有_____溶液的洗气瓶进行改进。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Cu(Ⅱ)盐晶体组成可表示为Ka[Cub(C2O4)c]·dH2O,为测定其组成,实验如下:
(1)溶液的配制
准确称取3.540 g样品,加入1mol·L-1H2SO4溶解,配制成100mL溶液。所需要的玻璃仪器有量筒、烧杯、胶头滴管、____、______。
(2)铜含量的测定
取所配溶液25.00mL于锥形瓶中,加入过量淀粉—KI溶液,充分反应后,生成的I2与12.50mL0.2000mol·L-1Na2S2O3恰好完全反应。已知:2Cu2++4I-=2CuI↓+I2,I2+2S2O32—= 2I-+S4O62—。判断生成的I2与Na2S2O3恰好完全反应的现象为______。3.540 g样品中n(Cu2+)=_____mol。
(3)草酸根含量的测定
取另一份所配溶液25.00mL于锥形瓶中,滴入0.1000 mol·L-1KMnO4溶液至恰好完全反应,消耗20.00 mL KMnO4溶液。已知:2MnO4—+5C2O42—+16H+=2Mn2++8H2O+10CO2↑,所配溶液中c(C2O42—)=____mol·L-1。
(4)计算该铜盐的组成(写出计算过程)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1,若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在___(填标号)。
a.离子键 b.共价键 c.配位键 d.范德华力
(2)ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答:
①H2Se的酸性比H2S________(填“强”或“弱”),SO32-离子的立体构型为________。
②H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:H2SeO4比H2SeO3酸性强的原因:__________。
(3)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①Zn2+基态核外电子排布式为___________________。
②与H2O分子互为等电子体的阴离子为________。
③)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活和生产过程中化学有着重要的应用,下列有关说法正确的是![]()
A.洪涝、地震灾区灾后常用石灰对环境进行消毒,是利用石灰可使蛋白质变性的性质
B.食品添加剂对人体均有益,因此在添加时无需对其用量进行严格控制
C.生活中常见的石英玻璃、普通玻璃、钢化玻璃都属于硅酸盐产品
D.根据分散系的稳定性,将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G都是有机化合物,它们的转化关系如下:
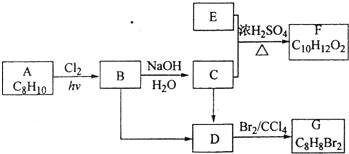
请回答下列问题:
(1)已知:6.0 g化合物E完全燃烧生成8.8 g CO2和3.6g H2O;E蒸气的密度标准状况下约为2.68g/L,则E的分子式为____________。
(2)A为一取代芳香烃,B中含有一个甲基。由B生成C的化学方程式为___________________。
(3)由B生成D、由C生成D的反应条件分别是________、________。
(4)由A生成B、由D生成G的反应类型分别是________、________。
(5)F存在于栀子香油中,其结构简式为_________________________。
(6)在G的同分异构体中,苯环上一硝化的产物只有一种的共有________种,其中核磁共振氢谱有两组峰,且峰面积比为1∶1的是____________(填结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com