
【题目】下列两个装置中,液体体积均为200mL,开始时电解质溶液的浓度均为0.1 mol/L,工作一段时间后,测得导线上都通过了0.02 mol电子,若不考虑溶液体积的变化,下列叙述中正确的是()
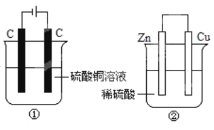
A.产生气体体积①=②
B.溶液的pH变化:①减小②增大
C.电极上析出固体质量①<②
D.电极反应式:①中阳极Cu2++2e—=Cu,②中负极Zn—2e—=Zn2+
【答案】B
【解析】
A.装置①属于电解池,阳极反应式为4OH--4e-=2H2O+O2↑,阴极反应式为Cu2++2e-=Cu,CuSO4的物质的量为200×10-3L×0.1mol·L-1=0.02mol,当电路中通过0.02mol电子,消耗Cu2+物质的量为0.01mol,只有阳极产生气体,即产生氧气的物质的量为![]() =0.005mol,体积为0.112L,装置②为原电池,正极上的反应式为2H++2e-=H2↑,产生氢气的体积为
=0.005mol,体积为0.112L,装置②为原电池,正极上的反应式为2H++2e-=H2↑,产生氢气的体积为![]() L=0.224L,故产生气体体积①<②,故A错误;
L=0.224L,故产生气体体积①<②,故A错误;
B.装置①总电极反应式为2Cu2++2H2O![]() 2Cu+O2↑+4H+,反应中产生氢离子,c(H+)增大,溶液pH减小,装置②发生Zn+H2SO4=ZnSO4+H2↑,反应中消耗氢离子,c(H+)降低,pH增大,故B正确;
2Cu+O2↑+4H+,反应中产生氢离子,c(H+)增大,溶液pH减小,装置②发生Zn+H2SO4=ZnSO4+H2↑,反应中消耗氢离子,c(H+)降低,pH增大,故B正确;
C.①的阴极反应Cu2++2e—=Cu,导线中通过0.2 mol电子时,阴极产生铜的质量m=nM=0.2mol×64g/mol=12.8g,装置②为原电池,两个电极上没有固体析出,则电极上析出固体质量①>②,故C错误
D.②中负极反应Zn-2e-=Zn2+,①中阳极4OH--4e-=2H2O+O2,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
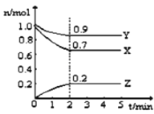
(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2 、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率 v(N2) = __________,250s时,H2的转化率为____________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___(填“吸收”或“放出”)的能量为____, 反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___(填“吸收”或“放出”)的能量为____, 反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
(4)反应达平衡时容器内混合气体的平均相对分子质量比起始时____(填增大、减小或不变),混合气体密度比起始时______(填增大、减小或不变)。
(5)为加快反应速率,可以采取的措施是_______
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如下:
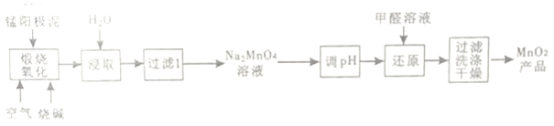
(1)“煅烧氧化”时,1mol MnO煅烧完全转化为Na2MnO4失去电子的物质的量为___________;MnO2煅烧反应的化学方程式为__________________。
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有____________、____________(列举2点)
(3)“调pH”是将溶液pH 调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应,生成MnO2和___________;写出用pH试纸测定溶液pH的操作_______________。
(4)“还原”时有无机含氧酸盐生成,发生反应的化学方程式为_____________。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1. 准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2. 然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是_____________;产品中MnO2的质量分数为ω(MnO2)=____________(列出计算的表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH值得盐酸和醋酸溶液分别加水稀释。pH值随溶液体积变化变化如图所示。据图判断正确的是()
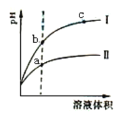
A.Ⅱ为盐酸稀释时pH值变化曲线
B.b点酸的总浓度小于a点酸的总浓度
C.两种酸的物质的量浓度一定相等
D.a点Kw的数值比b点Kw的数值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
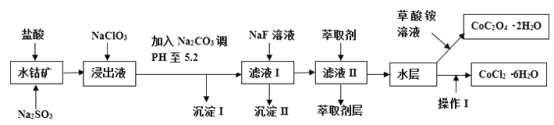
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;②沉淀I中只含有两种沉淀;③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为_________________。
(2)NaClO3在浸出液中发生的离子反应方程式为______________。
(3)加入Na2CO3调PH至5.2,目的是________;萃取剂层含锰元素,则沉淀II的主要成分为_____。
(4)操作I包括:将水层加入浓盐酸调整PH为2-3,______、_____、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是_____(回答一条原因即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W(分子式C3H6O3)能与NaHCO3反应产生CO2,也能与Na反应生成H2,且1 mol W与足量Na反应能生成1 mol H2,分子中核磁共振氢谱为四组峰,峰面积之比为3∶1∶1∶1。
(1)W的结构简式是______________。
(2)W在不同条件下可脱水形成不同物质。若两分子W反应形成环酯,写出反应方程式:_________________。
(3)W的某种同分异构体具有下列性质:
能发生的银镜反应;1 mol该物质能跟金属钠反应产生1 mol H2。
则该同分异构体的结构简式为____________(已知同一个碳原子上不能连接2个羟基)。
(4)W的工业合成路线如图所示:
乙烯![]() A
A![]() B
B![]() C
C![]() D
D![]()
![]() W
W
已知:Ⅰ.A、B、C、D与W分子中含有相同碳原子数;
Ⅱ.RCH2COOH![]()
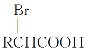
①写出A的名称:__________。
②B与新制Cu(OH)2悬浊液反应的化学方程式是: _______________。
③D与NaOH水溶液反应的化学方程式为:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以绿矾(主要成分FeSO4·7H2O,部分Fe2+已被氧化为Fe3+)为原料,生产铁红(Fe2O3)的工艺流程如下:
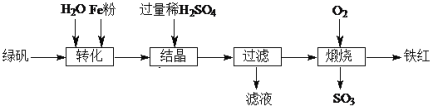
(1)“转化”过程中,加入Fe粉时发生反应的离子方程式为____;为提高该反应速率可采取的措施有:____、____。
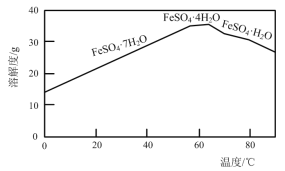
(2)“结晶”时,控制温度在75℃左右进行(相关物质的溶解度见下图),从溶液中析出的晶体是____(填化学式)。
(3)“滤液”的主要成分为FeSO4、____(填化学式)。利用该滤液将工业废水中的Cr2O72—还原为Cr3+,然后投加石灰乳,使Cr3+转化为Cr(OH)3,理论上完全反应消耗的n(FeSO4)∶n(Cr2O72—) =____。
(4)“煅烧”时生成铁红的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种新型液硫二次电池,其工作原理如图所示。下列说法错误的是

A. 放电时,电池左侧为负极,发生氧化反应
B. 充电时,电解质溶液中K+经交换膜向右侧移动
C. 放电时,电池右侧的电极反应为I3-+2e-=3I-
D. 充电时,电池的总反应为S22-+3I-![]() 2S2-+I3-
2S2-+I3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种短周期元素的原子序数依次增大;D的核电荷数是B的核电荷数的![]() 倍;A分别能与B、C、D形成电子总数相等的分子X、Y、Z。
倍;A分别能与B、C、D形成电子总数相等的分子X、Y、Z。
请回答下列问题:
(1)B、D两元素的名称分别是___、___。
(2)Y与C的最高正价氧化物的水化物恰好完全反应时,其生成物的水溶液呈___性(填“酸”“碱”或“中”),其原因是(用离子方程式示)___。
(3)在(2)所得生成物的水溶液中,存在着如下关系,请用粒子浓度符号填写:
①c(H+)+___=c(OH-)+___;
②c(NH![]() )+c(NH3·H2O)+c(NH3)=___。
)+c(NH3·H2O)+c(NH3)=___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com