
【题目】以绿矾(主要成分FeSO4·7H2O,部分Fe2+已被氧化为Fe3+)为原料,生产铁红(Fe2O3)的工艺流程如下:
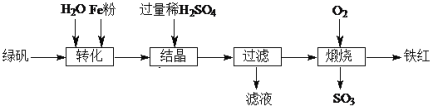
(1)“转化”过程中,加入Fe粉时发生反应的离子方程式为____;为提高该反应速率可采取的措施有:____、____。
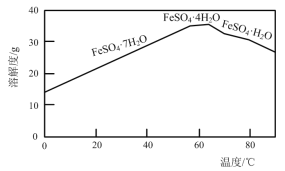
(2)“结晶”时,控制温度在75℃左右进行(相关物质的溶解度见下图),从溶液中析出的晶体是____(填化学式)。
(3)“滤液”的主要成分为FeSO4、____(填化学式)。利用该滤液将工业废水中的Cr2O72—还原为Cr3+,然后投加石灰乳,使Cr3+转化为Cr(OH)3,理论上完全反应消耗的n(FeSO4)∶n(Cr2O72—) =____。
(4)“煅烧”时生成铁红的化学方程式为____。
【答案】Fe+2Fe3+=3Fe2+ 搅拌 升高温度、研碎等 FeSO4·H2O H2SO4 6:1 4[FeSO4·H2O]+O2![]() 2Fe2O3+4SO3+4H2O
2Fe2O3+4SO3+4H2O
【解析】
绿矾溶于水后有铁离子,铁离子加入铁粉后变为亚铁离子,加入过量稀硫酸,控制温度析出FeSO4·H2O,在氧气中煅烧得到氧化铁。
⑴“转化”过程中,由于溶液中有部分铁离子,加入Fe粉时发生反应生成亚铁离子,其离子方程式为Fe+2Fe3+=3Fe2+;为提高该反应速率可采取的措施有:升高温度、搅拌、研碎等方法,
故答案为:Fe+2Fe3+=3Fe2+;搅拌;升高温度、研碎等;
⑵“结晶”时,根据溶解度曲线图,控制温度在75℃左右进行,从溶液中析出的晶体是FeSO4·H2O,
故答案为:FeSO4·H2O;
⑶“滤液”的主要成分为FeSO4、H2SO4。利用该滤液将工业废水中的Cr2O72-还原为Cr3+,亚铁化合价升高到铁离子,铁升高1价,重铬酸根离子降低6价,根据得失电子守恒,理论上完全反应消耗的n(FeSO4)∶n(Cr2O72-) = 6:1。
⑷“煅烧”时FeSO4·H2O在氧气中反应生成铁红,发生氧化还原反应,其反应的化学方程式为
4[FeSO4·H2O]+O2![]() 2Fe2O3+4SO3+4H2O,
2Fe2O3+4SO3+4H2O,
故答案为:4[FeSO4·H2O]+O2![]() 2Fe2O3+4SO3+4H2O。
2Fe2O3+4SO3+4H2O。


科目:高中化学 来源: 题型:
【题目】T℃时,在1L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论正确的是( )
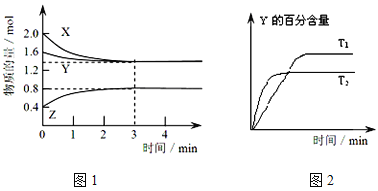
A.容器中发生的反应可表示为:X(g)+Y(g) ![]() Z(g)
Z(g)
B.保持其他条件不变,升高温度,反应的化学平衡常数K减小
C.反应进行的前3 min内,用X表示的反应速率 v(Z)=0.4mol/(L·min)
D.反应达到平衡后,增大压强,Z的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)配制250mL 0.2000 mol/L盐酸标准溶液,所需玻璃仪器有______、______量筒、烧杯、玻璃棒。
(2)盛装0.2000 mol/L盐酸标准液应该用______式滴定管。(填“酸”或“碱”)
(3)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_________,直到加入一滴盐酸后,溶液由_________,即到终点。
(4)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
④装标准溶液和待测液并调整液面(记录初始读数);
⑤用蒸馏水洗涤玻璃仪器;⑥滴定操作
正确的操作顺序为:_________。
(5)有关数据记录如下:
实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.60 | 20.70 |
2 | 20.00 | 6.00 | 25.90 |
3 | 20.00 | 1.40 | 23.20 |
则NaOH溶液的物质的量浓度为__________mol/L。
(6)若滴定时锥形瓶未干燥,则测定结果____________;若滴定前平视读数,滴定终点时仰视读数,则所测碱的浓度值_________。(填“无影响”、“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两个装置中,液体体积均为200mL,开始时电解质溶液的浓度均为0.1 mol/L,工作一段时间后,测得导线上都通过了0.02 mol电子,若不考虑溶液体积的变化,下列叙述中正确的是()
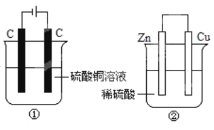
A.产生气体体积①=②
B.溶液的pH变化:①减小②增大
C.电极上析出固体质量①<②
D.电极反应式:①中阳极Cu2++2e—=Cu,②中负极Zn—2e—=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述中,不正确的是( )
A. 淀粉![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B. 纤维素![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C. 油脂![]() 甘油和高级脂肪酸
甘油和高级脂肪酸![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D. 蛋白质![]() 氨基酸
氨基酸![]() 人体所需的蛋白质(人体生长发育)
人体所需的蛋白质(人体生长发育)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
C.一定条件下,反应N2+3H2![]() 2NH3达到平衡时,3v正(H2)=2v逆(NH3)
2NH3达到平衡时,3v正(H2)=2v逆(NH3)
D.反应2NO(g)+2CO(g)===N2(g)+2CO2(g)常温下可自发进行,该反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) H1=-393.5kJ·mol-1
CO2(g)+C(s)=2CO(g) H2=+172.5kJ·mol-1
S(s)+O2(g)=SO2(g) H3=-296.0kJ·mol-1
写出CO除SO2的热化学方程式_______。
(2)某同学想利用下图装置验证同主族元素非金属性的变化规律。
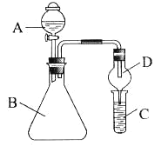
①若要证明非金属性Cl>I,则在A 中加浓盐酸,B中加KMnO4固体,C中加入淀粉碘化钾溶液,观察到C中溶液_____的现象,即可证明。从环境保护的观点考虑,此装置的缺点是_____。
②若要证明非金属性C>Si,则在A 中加盐酸,B中加CaCO3固体,C中加_____(写化学式)溶液。该同学认为若观察到C中溶液有白色沉淀生成,即可证明,该方案存在明显缺陷,可通过在两装置间添加装有_____溶液的洗气瓶进行改进。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1,若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在___(填标号)。
a.离子键 b.共价键 c.配位键 d.范德华力
(2)ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答:
①H2Se的酸性比H2S________(填“强”或“弱”),SO32-离子的立体构型为________。
②H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:H2SeO4比H2SeO3酸性强的原因:__________。
(3)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①Zn2+基态核外电子排布式为___________________。
②与H2O分子互为等电子体的阴离子为________。
③)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用光伏电池提供电能处理废水中的污染物(有机酸阴离子用R-表示),并回收有机酸HR,装置如图所示。下列说法错误的是
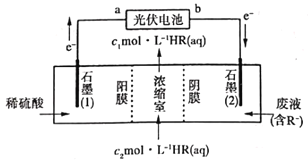
A.在光伏电池中a极为正极B.石墨(2)极附近溶液的pH降低
C.HR溶液:c2<c1D.若两极共收集3mol气体,则理论上转移4mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com