
【题目】已知A、B、C、D四种短周期元素的原子序数依次增大;D的核电荷数是B的核电荷数的![]() 倍;A分别能与B、C、D形成电子总数相等的分子X、Y、Z。
倍;A分别能与B、C、D形成电子总数相等的分子X、Y、Z。
请回答下列问题:
(1)B、D两元素的名称分别是___、___。
(2)Y与C的最高正价氧化物的水化物恰好完全反应时,其生成物的水溶液呈___性(填“酸”“碱”或“中”),其原因是(用离子方程式示)___。
(3)在(2)所得生成物的水溶液中,存在着如下关系,请用粒子浓度符号填写:
①c(H+)+___=c(OH-)+___;
②c(NH![]() )+c(NH3·H2O)+c(NH3)=___。
)+c(NH3·H2O)+c(NH3)=___。
【答案】碳 氧 酸 NH4++H2O![]() NH3·H2O+H+ c(NH4+) c(NO3-) c(NO3-)
NH3·H2O+H+ c(NH4+) c(NO3-) c(NO3-)
【解析】
已知A、B、C、D四种短周期元素的原子序数依次增大;D的核电荷数是B的核电荷数的![]() 倍;则B为Li、C、F、Mg中的一种,但是A分别能与B、C、D形成电子总数相等的分子X、Y、Z,则B为C,所以A为H,C为N,D为O;若形成的为10电子微粒则X为CH4,Y为NH3,Z为H2O;若形成的为18电子微粒则X为C2H6,Y为N2H4,Z为H2O2,据此解答。
倍;则B为Li、C、F、Mg中的一种,但是A分别能与B、C、D形成电子总数相等的分子X、Y、Z,则B为C,所以A为H,C为N,D为O;若形成的为10电子微粒则X为CH4,Y为NH3,Z为H2O;若形成的为18电子微粒则X为C2H6,Y为N2H4,Z为H2O2,据此解答。
(1)、由上述分析可知,B为碳,D为氧,故答案为:碳;氧;
(2)、要使Y能与C的最高正价氧化物的水化物恰好完全反应,则Y为NH3,X为CH4,Z为H2O,Y与C的最高正价氧化物的水化物刚好完全反应时,所得溶液为硝酸铵溶液,溶液中NH4+水解NH4++H2O![]() NH3·H2O+H+,破坏水的电离平衡溶液呈酸性,故答案为:酸;NH4++H2O
NH3·H2O+H+,破坏水的电离平衡溶液呈酸性,故答案为:酸;NH4++H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(3)①、根据溶液中电荷守恒解,可知c (H+) +c (NH4+) =c (OH-)+c (NO3-),故答案为:c(NH4+);c(NO3-);
②、根据物料守恒可知:c(NH4+)+c(NH3·H2O)+c(NH3)= c (NO3-),故答案为:c (NO3-)。


科目:高中化学 来源: 题型:
【题目】下列两个装置中,液体体积均为200mL,开始时电解质溶液的浓度均为0.1 mol/L,工作一段时间后,测得导线上都通过了0.02 mol电子,若不考虑溶液体积的变化,下列叙述中正确的是()
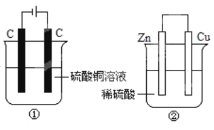
A.产生气体体积①=②
B.溶液的pH变化:①减小②增大
C.电极上析出固体质量①<②
D.电极反应式:①中阳极Cu2++2e—=Cu,②中负极Zn—2e—=Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1,若该反应中有4 mol N—H键断裂,则形成的π键有________mol。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在___(填标号)。
a.离子键 b.共价键 c.配位键 d.范德华力
(2)ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答:
①H2Se的酸性比H2S________(填“强”或“弱”),SO32-离子的立体构型为________。
②H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:H2SeO4比H2SeO3酸性强的原因:__________。
(3)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①Zn2+基态核外电子排布式为___________________。
②与H2O分子互为等电子体的阴离子为________。
③)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活和生产过程中化学有着重要的应用,下列有关说法正确的是![]()
A.洪涝、地震灾区灾后常用石灰对环境进行消毒,是利用石灰可使蛋白质变性的性质
B.食品添加剂对人体均有益,因此在添加时无需对其用量进行严格控制
C.生活中常见的石英玻璃、普通玻璃、钢化玻璃都属于硅酸盐产品
D.根据分散系的稳定性,将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol有机物X最多能与1 mol HCl发生加成反应得到Y,1 mol Y能与4 mol Cl2在一定条件下发生取代反应得到Z。已知Y分子中的碳碳键都是单键,Z分子中没有氢原子,则X的结构简式可能是( )
A.![]() B.CH≡CH
B.CH≡CH
C.![]() D.CH≡CCH3
D.CH≡CCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出)。且已知G为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,A、B、C、D、E、F六种物质中均含同一种元素。
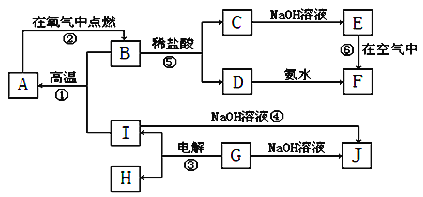
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素是___。
(2)写出C、G物质的化学式:C___,G___。
(3)写出④、⑥反应的化学方程式:
反应④:___;
反应⑥:___。
(4)从能量变化的角度看,①②③反应中属于吸热反应的是___。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用光伏电池提供电能处理废水中的污染物(有机酸阴离子用R-表示),并回收有机酸HR,装置如图所示。下列说法错误的是
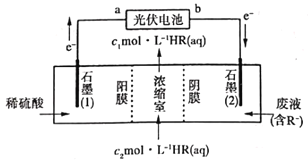
A.在光伏电池中a极为正极B.石墨(2)极附近溶液的pH降低
C.HR溶液:c2<c1D.若两极共收集3mol气体,则理论上转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G都是有机化合物,它们的转化关系如下:
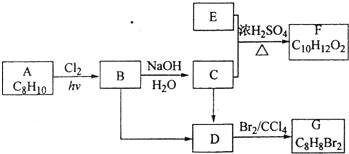
请回答下列问题:
(1)已知:6.0 g化合物E完全燃烧生成8.8 g CO2和3.6g H2O;E蒸气的密度标准状况下约为2.68g/L,则E的分子式为____________。
(2)A为一取代芳香烃,B中含有一个甲基。由B生成C的化学方程式为___________________。
(3)由B生成D、由C生成D的反应条件分别是________、________。
(4)由A生成B、由D生成G的反应类型分别是________、________。
(5)F存在于栀子香油中,其结构简式为_________________________。
(6)在G的同分异构体中,苯环上一硝化的产物只有一种的共有________种,其中核磁共振氢谱有两组峰,且峰面积比为1∶1的是____________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
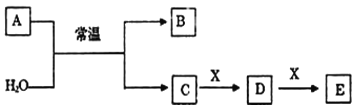
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:___。
(2)若A为淡黄色粉末,X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种稀溶液,可选择的试剂为___(填代号)。
A.盐酸 B.BaCl2溶液 C.Ca(OH)2溶液
(3)若A为非金属氧化物,B为气体,遇空气会变红棕色,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com