
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸. ②H2S可与许多金属离子反应生成沉淀. ③H2S在空气中燃烧,火焰呈淡蓝色. |
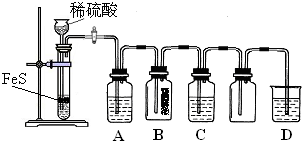
| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 反应现象 | 结论 |
| A+B | 产生无色气体 | B是 NaHCO3 NaHCO3 |
| A+C | 无明显现象 | C是 Na2SO4 Na2SO4 |
| A+D | 产生白色沉淀 | D是 BaCl2 BaCl2 |
| 甲组 | 乙组 | 丙组 | 丁组 | |
| X | BaCl2 | Na2CO3 | KCl | K2CO3 |
| Y | 硝酸 | 硝酸 | 盐酸 | 盐酸 |
| Z | Na2CO3 | AgNO3 | K2CO3 | BaCl2 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市天津一中高一上学期期末考试化学试卷(带解析) 题型:实验题
某化学兴趣小组在学习“硫的化合物的某些性质”中,进行了如下实验:
【实验一】探究SO2的性质,
按下图所示装置进行实验。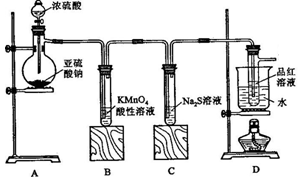
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象
______________________________________________;
(4)该装置有一明显缺陷,请指明_______________________,并在框图内画出补充装置(注明药品)。
【实验二】验证足量锌与浓硫酸反应产生的气体成分是二氧化硫和氢气。按下图装置进行实验(锌与浓硫酸共热时产生的气体为X,且该装置略去)。试回答:
(5)A中加入的试剂可能是____________,作用是_______________;
B中加入的试剂可能是____________,作用是_______________;
E中加入的试剂可能是____________,作用是_______________。
(6)可以证明气体X中含有氢气的实验现象是:C中:____________,D中:__________;
查看答案和解析>>
科目:高中化学 来源:2015届天津市高一上学期期末考试化学试卷(解析版) 题型:实验题
某化学兴趣小组在学习“硫的化合物的某些性质”中,进行了如下实验:
【实验一】探究SO2的性质,
按下图所示装置进行实验。

请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象
______________________________________________;
(4)该装置有一明显缺陷,请指明_______________________,并在框图内画出补充装置(注明药品)。

【实验二】验证足量锌与浓硫酸反应产生的气体成分是二氧化硫和氢气。按下图装置进行实验(锌与浓硫酸共热时产生的气体为X,且该装置略去)。试回答:

(5)A中加入的试剂可能是____________,作用是_______________;
B中加入的试剂可能是____________,作用是_______________;
E中加入的试剂可能是____________,作用是_______________。
(6)可以证明气体X中含有氢气的实验现象是:C中:____________,D中:__________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com