
����Ŀ����.ˮ������Ҫ�Ľ������ϡ�ˮ�����ϵ���Ҫ�ɷ�ΪCaO��SiO2��������һ��������������þ�Ƚ����������ʵ���Ҳⶨˮ����Ʒ�иƺ�����ij�ַ���������ͼ��ʾ��
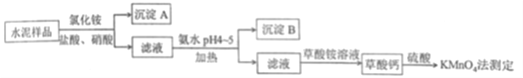
��1���ڷֽ�ˮ����Ʒ�����У�������Ϊ�ܼ����Ȼ��Ϊ���ܼ���������뼸�����ᡣ���������Ŀ����_____________������ʹ��__________�������ᡣ
��2������A����Ҫ�ɷ���________���䲻����ǿ�ᵫ����һ�����ᷴӦ���÷�Ӧ�Ļ�ѧ����ʽΪ____________��
��3���Ӱ�ˮ�����м��ȵ�Ŀ����_____������B����Ҫ�ɷ�Ϊ_______��_________���ѧʽ����
������֪25��ʱ����ĵ��볣��ΪK1=5.0��10-2,K2=5.4��10-5.����Ƶ�Kap=4.0��10-8.̼��Ƶ�Ksp=2.5��10-9����ͬ�¶���ˮ�����ӻ��������±���
t/�� | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
Kw/10-14 | 0.134 | 0.292 | 0.681 | 1.00 | 2.92 | 5.57 | 38.0 | 55.0 |
��1������25��ʱKHC2O4��Һ��ˮ��ƽ�ⳣ��Kb=_____��д��ˮ��Һ�в���ĵ��뷽��ʽ_____�������½�0.2mol/L��KOH��Һ10mL��0.2mol/L�IJ�����Һ20mL��Ϻ���Һ��________�ԡ���������������������������ȷ������
��2��25��ʱ��20mL����Ƶı�����Һ����μ���8.0��10-4mol/L��̼�����Һ10mL���ܷ����������_______���������������������� ̼���ת��Ϊ����Ƶ����ӷ���ʽΪ______����ʽ����÷���ƽ�ⳣ��K=_________��
��3��90��ʱ����0.005mol/L������������Һ20mL��0.0012mol/L�IJ�����Һ20mL��ϣ����Ϻ���Һ��pH______���������õ��Ķ�����lg38=1.6��lg26=2.4��lg2=0.3��
���𰸡� ������������ H2O2����ˮ�� SiO2 SiO2 + 4HF === SiF4��+ 2H2O �ٽ�Fe3+��Al3+ˮ�⣬���ٳ������� Fe(OH)3 Al(OH)3 2��10-13 H2C2O4![]() H++HC2O4-��HC2O4-
H++HC2O4-��HC2O4-![]() H++C2O42- �������10������ �� CaCO3(s) + C2O42- (aq)
H++C2O42- �������10������ �� CaCO3(s) + C2O42- (aq) ![]() CaC2O4(s) + CO32- (aq)
CaC2O4(s) + CO32- (aq) ![]() 10
10
����������1����������������Ҫ��ͨ��ת��Ϊ�������������ķ�ʽ��ȥ�����Լ��������Ŀ���ǽ�������������Ϊ�����ӣ��Ա��ڳ������ӡ��������⣬������ʹ����ɫ���������������⣬�Ա�֤���������ʡ�����ˮ����Ҳ��һ�ֿ��е�ѡ����Ϊ�������д��ڵ������Ӿ��������ӡ�
��2������ˮ���еijɷ֣�һ��������費�����ᣬ���Գ���A��Ҫ�Ƕ������衣�����������ķ�ӦΪ��SiO2 + 4HF === SiF4��+ 2H2O��
��3�����ȿ���ʹ���ɵĽ���۳������⽺������ɣ����ڳ����ķ��룻pHΪ4��5ʱCa2+��Mg2+��������Fe3+��Al3+���������Գ���BΪFe(OH)3��Al(OH)3��
����1��HC2O4-��ˮ�ⷽ��ʽΪ��HC2O4-+H2OH2C2O4+OH-��HC2O4-��ˮ��ƽ�ⳣ��Ϊ��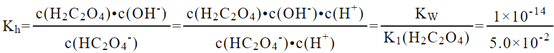 ������Kh= 2��10-13������Ϊ��Ԫ���ᣬ������̷ֲ����У�����ĵ��뷽��ʽΪ��H2C2O4
������Kh= 2��10-13������Ϊ��Ԫ���ᣬ������̷ֲ����У�����ĵ��뷽��ʽΪ��H2C2O4![]() H++HC2O4-��HC2O4-
H++HC2O4-��HC2O4-![]() H++C2O42-�������½�0.2mol/L��KOH��Һ20mL��0.2mol/L�IJ�����Һ20mL��ϣ���Ӧ��õ����������Һ�����ڲ���������ӵĵ���ƽ�ⳣ����K2��������ˮ��ƽ�ⳣ����Kh�������Ե���ռ������λ����Һ�����ԡ�
H++C2O42-�������½�0.2mol/L��KOH��Һ20mL��0.2mol/L�IJ�����Һ20mL��ϣ���Ӧ��õ����������Һ�����ڲ���������ӵĵ���ƽ�ⳣ����K2��������ˮ��ƽ�ⳣ����Kh�������Ե���ռ������λ����Һ�����ԡ�
��2��̼�����Һ�и�����Ũ��=![]() =5��10-5mol/L������Ϻ�����Ũ��=
=5��10-5mol/L������Ϻ�����Ũ��=![]() ��10-5mol/L������ص�Ũ��Ϊ
��10-5mol/L������ص�Ũ��Ϊ![]() ��10-4mol/L����Ϻ�c(Ca2+)c(C2O42-)=
��10-4mol/L����Ϻ�c(Ca2+)c(C2O42-)=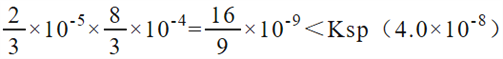 ����������̼���ת��Ϊ����Ƶ����ӷ���ʽΪ��CaCO3(s) + C2O42- (aq)
����������̼���ת��Ϊ����Ƶ����ӷ���ʽΪ��CaCO3(s) + C2O42- (aq) ![]() CaC2O4(s) + CO32- (aq)�����Ը÷�Ӧ��ƽ�ⳣ��Ϊ��
CaC2O4(s) + CO32- (aq)�����Ը÷�Ӧ��ƽ�ⳣ��Ϊ��![]() ��
��
��3���������ƺͲ�������ʵ�����Ӧ���ɲ���Ƴ�����ˮ������0.005mol/L������������Һ20mL��0.0012mol/L�IJ�����Һ20mL��ϣ��õ�����(0.005��0.0012)��2=0.0019mol/L������������Һ���������������ӵ�Ũ��Ϊ0.0038mol/L������90���µ�������Ϊ38��10-14��0.0038=1��10-10mol/L������pH=10��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������һ�����ܱ������н������·�Ӧ��X2(g)+2Y2(g)![]() 2Z(g)����֪X2��Y2��Z����ʼŨ�ȷֱ�Ϊa mol/L��b mol/L�� 0.2mol/L����ƽ��̬������һ�������£�����Ӧ�ﵽƽ��ʱ��Z��Ũ��Ϊ 0.3mol/L���������ж���ȷ���ǣ� ��
2Z(g)����֪X2��Y2��Z����ʼŨ�ȷֱ�Ϊa mol/L��b mol/L�� 0.2mol/L����ƽ��̬������һ�������£�����Ӧ�ﵽƽ��ʱ��Z��Ũ��Ϊ 0.3mol/L���������ж���ȷ���ǣ� ��
A. b��0.1mol/L
B. �ı�����������ƽ��ʱZ��ƽ��Ũ��c��0.2mol/L��c��0.3mol/L
C. a��0.05 mol/L
D. ��ƽ��ʱ�������ʵ���Ũ��֮��С�ڣ�a+b+0.2��mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������еIJ��ֵ�Դ��![]() �Ժ�ˮ��
�Ժ�ˮ��![]() �����������ѧС�����
�����������ѧС�����![]() �뺬
�뺬![]() ��Һ��Ӧ������о���
��Һ��Ӧ������о���
��1��![]() ��
��![]() ��������
��������![]() �Ĺ�����3����Ӧ��ɣ�
�Ĺ�����3����Ӧ��ɣ�
��![]()
![]()
��![]()
![]()
��![]()
![]()
���Ȼ�ѧ����ʽ��ʾ![]() ����
����![]() ����
����![]() �ķ�Ӧ______��
�ķ�Ӧ______��
��2��![]() ��ˮ���ֽ⣬һ�������£�
��ˮ���ֽ⣬һ�������£� ![]() ��Ũ�ȼ���һ��ʱ�����ʱ�䣨t�����±���ʾ����֪��
��Ũ�ȼ���һ��ʱ�����ʱ�䣨t�����±���ʾ����֪�� ![]() ����ʼŨ��Ϊ
����ʼŨ��Ϊ![]()
pH t/min T/�� | 3��0 | 4��0 | 5��0 | 6��0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
��![]() �����ܼ���
�����ܼ���![]() �ֽ⣬������
�ֽ⣬������![]() �ֽ�������õ���___________��
�ֽ�������õ���___________��
�ڸ��ݱ������ݣ��Ʋ�![]() �����������·ֽ��������������˳��Ϊ__________������ĸ���ţ�
�����������·ֽ��������������˳��Ϊ__________������ĸ���ţ�
a. 40����![]() b. 10����
b. 10����![]() c. 30����
c. 30����![]()
��3��![]() ��KI��Һ�д�������ƽ�⣺
��KI��Һ�д�������ƽ�⣺![]() ����ò�ͬ�¶��¸÷�Ӧ��ƽ�ⳣ����ͼ��ʾ������˵����ȷ����__________��
����ò�ͬ�¶��¸÷�Ӧ��ƽ�ⳣ����ͼ��ʾ������˵����ȷ����__________��

A. ��Ӧ![]() ��
��![]()
B. ���ø÷�Ӧ���Գ�ȥ����������ĵⵥ��
C. ������ƽ����ϵ�м��뱽��ƽ�ⲻ�ƶ�
D. 25��ʱ��������ƽ����ϵ�м�������![]() ���壬ƽ�ⳣ��KС��680
���壬ƽ�ⳣ��KС��680
��4����![]() ����
����![]() �У��õ��Ϻ�ɫ����Һ���ټ���һ��Ũ�ȵ�
�У��õ��Ϻ�ɫ����Һ���ټ���һ��Ũ�ȵ�![]() ��Һ��������ͼ��ʾ��
��Һ��������ͼ��ʾ��

���ϲ���Һ�к���Ԫ�ص�����_______________���û�ѧ���ű�ʾ����
����ʵ��������Ʋ����![]() �ܽ��ԵĽ�����______________��
�ܽ��ԵĽ�����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϵΪԪ�����ڱ��е���B�塢ԭ������Ϊ57~71��Ԫ�ء�
��1����(Dy)�Ļ�̬ԭ�ӵ����Ų�ʽΪ[Xe]4f106s2��������(Dy)ԭ����Χ�����Ų�ͼ��___________��
��2�����³��������籵ͭ�������к���Cu3+����̬ʱCu3+ �ĵ����Ų�ʽΪ________________��
��3���۲�����������ϵԪ�صĵ������������ж����п�����ʾ+3 �۵�Ԫ����___________(��Ԫ������)��������ϵԪ�صĵ�����(��λ��kJ mol-1)
Ԫ�� | I1 | I2 | I3 | I4 |
Yb(� | 604 | 1217 | 4494 | 5014 |
Lu(�壩 | 532 | 1390 | 4111 | 4987 |
La(�磩 | 538 | 1067 | 1850 | 5419 |
Ce(�棩 | 527 | 1047 | 1949 | 3547 |
��4��Ԫ����(Ce)�����γ������(NH4)2[Ce(NO3)6]��
���������������Ԫ�����縺���ɴ�С��˳��Ϊ________________(��Ԫ�ط��ű�ʾ)��
��д�����������̬�⻯��ˮ��Һ�д��ڵ������__________________(��дһ��)��
��Ԫ��Al Ҳ�����Ƴɼ��������̬�Ȼ������ӱ�ʾΪ(AlCl3)2��������Al ԭ���ӻ���ʽΪ_____________��������������ѧ��������______________(����ĸ)��
a.���Ӽ� b.���Լ� C.�Ǽ��Լ� d.��λ��
��5��PrO2(��������)�ľ���ṹ��CaF2��������������ԭ��λ�����ĺͶ�������PrO2(��������)�ľ�������________����ԭ������֪��������Ϊa pm���ܶ�Ϊ�� g�� cm-3��NA=_____________ (�ú�a�����Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�Ԫ�����ʵݱ�����У��������
A.Li��Be��Bԭ��������������������B.N��O��FԪ����������ϼ���������
C.Mg��Al��Siԭ�Ӱ뾶���μ�СD.P��S��ClԪ�صĸ����ϼ�����Ϊ��3����2����1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������÷�Һ©�������һ��Һ�������ǣ�������
A. ������Ȼ�̼ B. �����屽
C. ˮ�ͼױ� D. �屽��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. 18g2H2O�к��е�������Ϊ10NA
B. 11.2 LCl2������NaOH ��Һ��Ӧʱת�Ƶĵ�����Ϊ0.5 NA
C. 1mol��L-1��Fe2(SO4)3��Һ�к��е�SO42-��Ϊ3 NA
D. 7 g ��ϩ�Ͷ�ϩ�Ļ��������������̼ԭ������0.5 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ��һ�ֳ����Լ����磺��������������ͭ��֤��ȩ�Ļ�ԭ�ԡ�
(1)����������ͭ����Һ�����ƣ����Թ������10%��������ͭ��Һ2mL������2%������ͭ��Һ4��6�Σ�������������Ŀ����________________________��
(2)������ij�о���ѧϰС�鿪չ��̽����ѧϰ���
������⣺�ԡ���ȩ������������ͭ����Һ��Ӧ���ɵĺ�ɫ������Cu2O��������ɣ�������Ϊ��ɫ������һ����������ͭ��Ϊ��ȷ����ɫ�����ijɷ֣�����������̽����
������룺________________________��
�������ϣ���������ͭ���ڼ��������
�ڣ�1�۵�ͭ������������������������������ԭ��Ӧ��
���ڿ���������������ͭ��������ͭ��
��Ʒ�����
����1��ȡ�ú�ɫ������������ϡ�����У��۲���Һ��ɫ�仯��
����2��ȡ�ú�ɫ��������������ϡ�����У��۲��Ƿ��в�����
����3����ȡ�ú�ɫ����ag���ڿ����г����������ȫ��ڣ����ڸ���������ȴ���ٳ�����������Σ�ֱ��������أ��Ƶ�����Ϊbg���Ƚ�a��b�Ĵ�С��
����4��ȡ��ɫ�������ڴ��Թ�������ữ����������Һ���۲��Ƿ�������ɫ����������
����Ϊ�����ķ�����____________��
(3)��������Ϊ11.6%��ij����һԪȩˮ��Һ5g�����������Ƶ�Cu(OH)2����Һ��Ӧ������Cu2O1.44g������ȩ��________���ṹ��ʽΪ________��������������Cu(OH)2����Һ��Ӧ�Ļ�ѧ����ʽΪ__________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com