
【题目】某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去)。

(1)配制氯化铁溶液时,需先把氯化铁晶体溶解在______中,再加水稀释,这样操作的目的是__________________________________________。
(2)通入足量SO2时,装置C中观察到的现象为___________________________________。
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式____________________________________;
②请设计实验方案检验有Fe2+ 生成___________________________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42 -,该做法____(填“合理”或“不合理”),理由是__________。
(4)D装置中倒置漏斗的作用是_________________________________________________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有____________(填字母)。
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
【答案】浓盐酸抑制氯化铁水解溶液由棕黄色变为浅绿色2Fe3+ + SO2 +2H2O=SO42-+4H++2Fe2+取少量C中反应后的溶液于试管中,向其中滴入酸性高锰酸钾溶液,若褪色,说明有亚铁离子,不褪色说明没有亚铁离子不合理硝酸可以将溶解的SO2氧化为 H2SO4,干扰实验使气体充分吸收;防止溶液倒吸b、c
【解析】
本题为用题给图示装置进行SO2 与FeCl3溶液反应的相关实验,A装置为SO2发生装置,B装置为安全装置,C装置用于进行SO2 与FeCl3溶液反应,D装置则是SO2尾气处理。SO2 与FeCl3溶液反应可以通过溶液颜色的变化证明,装置C中观察到溶液由棕黄色变为浅绿色,
检验Fe3+中存在的Fe2+,可以用酸性KMnO4溶液,若褪色,说明有亚铁离子;若将FeCl3溶液改用酸性KMnO4溶液则溶液紫红色逐渐变浅,若该用碘水,则黄色逐渐褪去;D装置采用防倒吸的装置,以此分析解答。
(1)配制氯化铁溶液时,为了抑制Fe3+的水解,需先把氯化铁晶体溶解在浓盐酸中,再加水稀释,
故答案为:浓盐酸;抑制氯化铁水解;
(2)SO2时通入FeCl3溶液中时,SO2表现出还原性,能将Fe3+还原为Fe2+,则装置C中观察到的现象为溶液由棕黄色变为浅绿色,
故答案为:溶液由棕黄色变为浅绿色;
(3)①根据以上分析可知,装置C中发生SO2与FeCl3溶液反应的离子方程式2Fe3+ + SO2 +2H2O=SO42-+4H++2Fe2+;
②检验装置C中有Fe2+ 生成的方法为:取少量C中反应后的溶液于试管中,向其中滴入酸性高锰酸钾溶液,若褪色,说明有亚铁离子,不褪色说明没有亚铁离子,
③加入的硝酸可以将溶解的SO2氧化为 H2SO4,会干扰实验,故该做法不合理,
故答案为:2Fe3+ + SO2 +2H2O=SO42-+4H++2Fe2+ ;取少量C中反应后的溶液于试管中,向其中滴入酸性高锰酸钾溶液,若褪色,说明有亚铁离子,不褪色说明没有亚铁离子;不合理; 硝酸可以将溶解的SO2氧化为 H2SO4,干扰实验;
(4)装置D中倒置漏斗能将SO2尾气充分吸收,且能防止溶液倒吸,
故答案为:使气体充分吸收;防止溶液倒吸;
(5)要验证SO2具有还原性,应选择具有强氧化性的试剂,且实验过程有明显的实验现象,b、c项试剂均可代替FeCl3溶液。
故答案为:b、c。


科目:高中化学 来源: 题型:
【题目】从香荚兰豆中提取的一种芳香化合物,其分子式为C8H8O3,遇FeCl3溶液会呈现特征颜色,能发生银镜反应。该化合物可能的结构简式是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到相应实验目的的是
选 项 | 试剂 | 实验目的 | 实验装置 | ||
X | Y | Z | |||
A | Na2SO3 | 稀HNO3 | 品红溶液 | 证明SO2具有漂白性 |
|
B | MnO2 | 浓盐酸 | KI-淀粉溶液 | 比较Cl2与I2的氧化性强弱 | |
C | Na2CO3 | 醋酸 | Na2SiO3溶液 | 证明酸性: CH3COOH > H2CO3 >H2SiO3 | |
D | 蔗糖 | 浓硫酸 | 溴水 | 证明浓硫酸具有脱水性、氧化性 | |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的下列说法中不正确的是( )
A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在NaCl晶体中,每个晶胞平均占有4个Na+
C. 金属导电是因为在外加电场作用下产生自由电子
D. 铜晶体为面心立方堆积,铜原子的配位数(距离一个铜原子最近的其他铜原子的个数)为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持、加热仪器已略去,气密性已检验)。
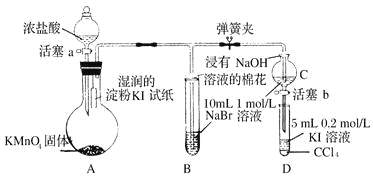
实验过程;
I.打开弹簧夹,打开活塞a,清加浓盐酸。II.当 B 和C 中的溶液都变为黄色时,夹紧弹簧夹。Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。Ⅳ……
(1)A中产生的是黄绿色气体,其离子方程式为____________,在该反应中浓盐酸表现了___________性。
(2)验证氯气的氧化性强于碘的实验现象是___________________________。
(3)B 中溶液发生反应的离子方程式是__________________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是________________________。
(5)过程Ⅲ实验的目的是__________________________。
(6)从元素周期表的递变规律的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 澄清石灰水与过量苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
B. 少量SO2通入饱和的漂白粉溶液中:C1O-+SO2+H2O=SO42-+2H++Cl-
C. 向热的稀硫酸中加入铜粉并鼓入空气:2Cu+4H++O2![]() 2Cu2++2H2O
2Cu2++2H2O
D. 向酸性高锰酸钾溶液中滴加少量双氧水:7H2O2+2MnO4-+6H+=2Mn2++6O2↑+10H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com