
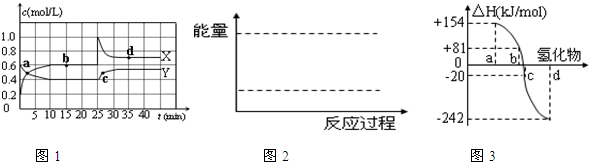
| △c |
| △t |
| 0.4mol/L |
| 10min |
| 0.4 |
| 0.62 |
| 10 |
| 9 |
| 10 |
| 9 |
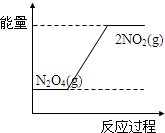 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 |
| 甲同学:取少量(0.5~2mL)小烧杯中的溶液于洁净试管中,滴加1~2滴20%KSCN溶液 | ①若溶液显血红色,则假设 ②若溶液不发生颜色变化,则假设 |
乙同学: | ③若粉末 ④若粉末 ⑤若粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制200mL 1.0mol/L的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制200mL 1.0mol/L的稀硫酸.可供选用的仪器有:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤⑥ |
| B、②⑤④①③⑥ |
| C、①②④⑤③⑥ |
| D、④②③①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
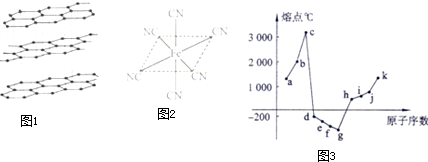
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、火锅城的行为违法 |
| B、火锅城欺骗他人吸食毒品 |
| C、吗啡、病毒、海洛因都是毒品 |
| D、罂粟壳是人工合成的毒品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com