
|
浓硫酸在下列物质的转化中,既表现出氧化性,又表现出酸性的是 | |
A. |
Cu→CuSO4 |
B. |
C→CO2 |
C. |
FeO→Fe2(SO4)3 |
D. |
Fe2O3→Fe2(SO4)3 |
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:

| 醇 |
| △ |
| 醇 |
| △ |
| 催化剂 |
| 催化剂 |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
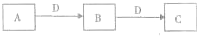
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源:2012届浙江省开化县华埠中学高三化学冲刺综合测试化学试卷(带解析) 题型:实验题
CuSO4?5H2O是铜的重要化合物,有着广泛的应用。CuSO4?5H2O的实验室制法如下:
Ⅰ.实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程(Fe3+在pH=5时已完全沉淀)
回答下列问题:
⑴用98%的浓硫酸配制溶解所用的4.5 mol?L-1的稀硫酸,只需 种玻璃仪器
⑵步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是
发生反应的离子方程式:
⑶如何证明Fe2+已经充分转化?
⑷步骤④之后的实验操作是 ,所需仪器是铁架台(带铁圈)、
及抽滤装置。
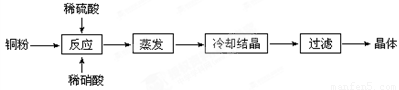
Ⅱ.实验室用铜粉制备的CuSO4?5H2O流程图如下:
根据题意完成下列填空:
⑴理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为 ,
发生反应的离子方程式为 。
⑵实际制得的胆矾晶体中还是含有一些杂质,通常采用 法提纯。
⑶实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是
。
请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。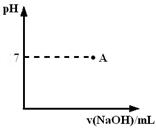
⑷上述使用的标准氢氧化钠溶液已经通过基准物质的标定。下列物质中通常可用来标定碱液的基准物质是 。
| A.醋酸 | B.草酸 | C.苯甲酸 | D.苯酚 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三化学冲刺综合测试化学试卷(解析版) 题型:实验题
CuSO4∙5H2O是铜的重要化合物,有着广泛的应用。CuSO4∙5H2O的实验室制法如下:
Ⅰ.实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程(Fe3+在pH=5时已完全沉淀)

回答下列问题:
⑴用98%的浓硫酸配制溶解所用的4.5 mol∙L-1的稀硫酸,只需 种玻璃仪器
⑵步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是
发生反应的离子方程式:
⑶如何证明Fe2+已经充分转化?
⑷步骤④之后的实验操作是 ,所需仪器是铁架台(带铁圈)、
及抽滤装置。
Ⅱ.实验室用铜粉制备的CuSO4∙5H2O流程图如下:
根据题意完成下列填空:
⑴理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为 ,
发生反应的离子方程式为 。
⑵实际制得的胆矾晶体中还是含有一些杂质,通常采用 法提纯。
⑶实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是
。
请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。

⑷上述使用的标准氢氧化钠溶液已经通过基准物质的标定。下列物质中通常可用来标定碱液的基准物质是 。
A.醋酸 B.草酸 C.苯甲酸 D.苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com