
科目:高中化学 来源: 题型:
某温度下,H2(g)+CO2(g)  H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是
H2O(g)+CO(g)的平衡常数K=9/4,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol·L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol·L-1 | 0.010 | 0.010 | 0.020 |
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验所用的试纸不能预先用蒸馏水润湿的是( )
A.用品红试纸检验SO2
B.用淀粉碘化钾试纸检验Cl2
C.用红色石蕊试纸检验NH3
D.用pH试纸测定某溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组在实验室中用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝。回答下列问题:

(1)在实验中需用1 mol/L的NaOH溶液480 mL,配制该溶液已有下列仪器:托盘天平(砝码)、胶头滴管、药匙、玻璃棒,还缺少的仪器是________________。在灼烧操作中用到下列仪器中的一种,其名称是________________。
(2)写出步骤①中发生反应的离子方程式
________________________________________________________________________。
(3)操作③中洗涤如何操作______________________________________.
 (4)甲同学在实验室中用如图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象。
(4)甲同学在实验室中用如图装置制备CO2气体,并通入滤液B中制备Al(OH)3时,结果没有产生预期现象。
乙同学分析认为:甲同学通入CO2的量不足是导致实验失败的原因之一,你认为乙的分析是否合理?______________________。若合理,请用离子方程式解释其原因________________________。(若你认为不合理,该空不作答)
丙同学分析认为:甲同学通入的CO2中含有HCl气体,也是导致实验失败的原因,在实验中增加某装置可解决这个问题。请帮助丙同学画出该装置图,并注明试剂名称。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,水既不作氧化剂,也不作还原剂的氧化还原反应是( )
A.Na +H2O B.Fe + H2O(g) C.CO2 +H2O D.Na2O2 +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)利用SiO2的化学性质,写出实现下列变化的化学方程式。
SiO2 → 硅酸
SiO2 →高纯度的硅
(2)实验室中盛放强碱(氢氧化钠)溶液的玻璃试剂瓶不能用玻璃塞,试说明原因:
查看答案和解析>>
科目:高中化学 来源: 题型:
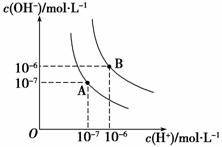
(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)________ mol·L-1,KW(25℃)________KW(100 ℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25 ℃) |
| HCN | K=4.9×10-10 mol·L-1 |
| CH3COOH | K=1.8×10-5 mol·L-1 |
| H2CO3 | K1=4.3×10-7 mol·L-1、 |
| K2=5.6×10-11 mol·L-1 |
①25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为__________________________________________________________________。
②25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则
c(Na+)________________________________________________________________________
c(CH3COO-)(填“>”、“<”或“=”)。
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com