
【题目】电解质溶液的电导率越大,导电能力越强。用浓度为0.100mol/L的NaOH溶液滴定10.00mL浓度均为![]() 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是
的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是
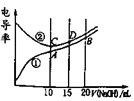
A.曲线①代表滴定CH3COOH溶液的曲线
B.A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol/L
C.在相同温度下,A、B、C三点溶液中水电离的c(H+)关系:B<A<C
D.D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
【答案】C
【解析】
溶液导电能力与离子浓度成正比,CH3COOH是弱电解质,溶液中离子浓度较小,加入NaOH后,溶液中离子浓度增大,溶液导电性增强;HCl是强电解质,随着KOH溶液加入,溶液体积增大,导致溶液中离子浓度减小,溶液导电能力减弱,当完全反应时离子浓度最小,继续加入KOH溶液,离子浓度增大,溶液导电能力增强,根据图知,曲线②代表0.1mol/L KOH溶液滴定HCl溶液的滴定曲线,曲线①代表0.1 mol/LKOH溶液滴定CH3COOH溶液的滴定曲线,据此分析。
根据上述分析可知曲线①代表0.1 mol/LKOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1mol/L NaOH溶液滴定HCl溶液的滴定曲线。
A.由分析可知,曲线①代表滴定CH3COOH溶液的曲线,A正确;
B.A点溶液中c(Na+)=0.05mol/L,电解质溶液中都存在电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)-c(H+)=c(Na+)=0.05mol/L,B正确;
C.酸或碱抑制水电离,含有弱离子的盐促进水电离,C点溶质为NaCl,A点溶质为醋酸钠,促进水电离,B点为等物质的量浓度的醋酸钠和NaOH,NaOH会抑制水的电离,所以在相同温度下,水电离的c(H+):B<C<A,故C错误;
D.D点溶液中,c(Na+)=1.5c(Cl-),溶液中电荷守恒为c(Cl-)+c(OH-)=c(Na+)+c(H+),则c(Cl-)=2 c(OH-)-2c(H+),D正确;
故合理选项是C。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应A(g)+B(g)![]() C(g),若反应物A的浓度从2 mol·L-1降到0.8 mol·L-1需20 s,则反应物A的浓度由0.8 mol·L-1降到0.2 mol·L-1所需的反应时间( )
C(g),若反应物A的浓度从2 mol·L-1降到0.8 mol·L-1需20 s,则反应物A的浓度由0.8 mol·L-1降到0.2 mol·L-1所需的反应时间( )
A. 等于10 sB. 大于10 sC. 小于10 sD. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体立体构型示意图如下图所示。


(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:________,C:________,D:__________________________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是__________________________________________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取500mL Na2CO3溶液与300mL 1mol/L盐酸反应。在不断搅拌下,将Na2CO3溶液逐滴滴入盐酸中与将盐酸逐滴滴入Na2CO3溶液中,所产生气体的物质的量之比为3:2,则Na2CO3溶液的物质的量浓度为
A.0.4mol/LB.0.3mol/LC.0.2mol/LD.0.15mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.25℃时,测得0.1mol/L的一元碱MOH溶液pH=11,则MOH一定为弱碱
B.25℃时,将pH=1的H2SO4溶液加水稀释10倍,所得溶液的c(SO42-)为0.005mol/L
C.25℃时,将![]() 的一元碱MOH溶液加水稀释至pH=10,所得溶液c(OH-)=10-4mol/L
的一元碱MOH溶液加水稀释至pH=10,所得溶液c(OH-)=10-4mol/L
D.25℃时,pH=12的一元碱MOH溶液与pH=2的盐酸等体积混合,所得溶液pH≤7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中大量存在五种离子:NO3—、SO42—、Fe3+、H+、X,其物质的量之比为:n(NO3—):n(SO42—):n(Fe3+):n(H+):n(X)=2:3:1:3:1,则X可能为
A. Na+ B. Mg2+ C. Cl— D. Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是
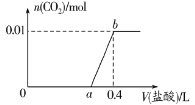
A.在0~a范围内,只发生中和反应
B.a=0.2
C.ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
CO2体积(mL) | 672 | 840 | 896 | 672 |
(1)样品中的物质的量之比n(Na2CO3)∶n(NaHCO3)=________。
(2)盐酸的物质的量浓度c(HCl)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计如下实验探究某矿石(仅含四种短周期元素)的组成和性质,已知矿石含有一定的结晶水:
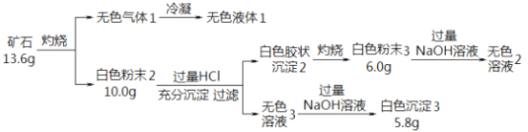
(1)矿石的组成元素是 H、O 和_____、 ______(填元素符号),化学式为_____________。
(2)白色粉末3 溶于NaOH溶液的离子方程式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com