
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用移液管(或碱式滴定管)量取25.00 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL 请完成下列问题:
(1)正确的操作步骤是(填写字母) _____________________________________.
(2)滴定管读数应注意_________________________________________________.
(3)操作中锥形瓶下垫一张白纸的作用是______________________________________.
(4)操作D中液面应调整到________________________;尖嘴部分应____________.
(5)滴定到终点时锥形瓶内溶液的pH约为___________;终点时的颜色变化是________.
(6)若酸式滴定管没用标准H2SO4润洗,会对测定结果有何影响________,若酸式滴定管终点读数俯视,对测定结果有何影响__________(填“偏高”、“偏低”或“无影响”,其他操作均正确).
(7)该烧碱样品的纯度计算式是_______________________________________.
【答案】 C A BD E 滴定管垂直 装液和放液后需要等一会,等液面上下不发生变化时才能读数;读数时要平视,视线与凹液面最低点相平;读数应到0.01 mL 便于准确判断滴定终点时溶液的颜色变化情况 零刻度或零刻度以下的某一刻度 充满溶液,无气泡 3.1~4.4 由黄色变为橙色 偏高 偏低 ![]() %
%
【解析】(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,故答案为:CABDE;
(2)滴定管读数时滴定管须垂直,装液和放液后需要等一会,等液面上下不发生变化时才能读数;读数时要平视,视线与凹液面最低点相平;读数应到0.01 mL,故答案为:滴定管垂直;装液和放液后需要等一会,等液面上下不发生变化时才能读数;读数时要平视,视线与凹液面最低点相平;读数应到0.01 mL;
(3)操作中锥形瓶下垫一张白纸,可以使滴定终点颜色变化更明显,便于分辨,故答案为:便于准确判断滴定终点时溶液的颜色变化情况;
(4)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡,故答案为:零刻度或零刻度以下的某一刻度;充满溶液,无气泡;
(5)指示剂为甲基橙,变色范围为3.1-4.4,终点时pH约为4左右,溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;故答案为:4左右(或3.1-4.4);溶液由黄色变为橙色;
(6)若酸式滴定管没用标准H2SO4润洗,会导致标准液的浓度偏小,滴定过程中消耗的标准液的体积偏大,根据c(待测)= 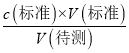 ,c(待测)偏高;若酸式滴定管终点读数俯视,会导致读数偏小,使得标准液的体积偏小,根据c(待测)=
,c(待测)偏高;若酸式滴定管终点读数俯视,会导致读数偏小,使得标准液的体积偏小,根据c(待测)= 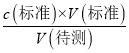 ,c(待测)偏低,故答案为:偏高;偏低;
,c(待测)偏低,故答案为:偏高;偏低;
(7)滴到消耗的硫酸为:n(硫酸)=cV=(V2-V1)×10-3L×m mol/L,根据反应方程可知,n(NaOH)=2n(硫酸)=2m(V2-V1)×10-3mol,所以原来样品中氢氧化钠的物质的量为:2m(V2-V1)×10-3mol×![]() =2m(V2-V1)×10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=80m(V2-V1)×10-2g,则该烧碱样品的纯度为:
=2m(V2-V1)×10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=80m(V2-V1)×10-2g,则该烧碱样品的纯度为: ![]() ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为: ![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: 
(1)从氯化钾溶液中得到氯化钾固体,选择装置(填代表装置图的字母,下同);除去自来水中的Cl﹣等杂质,选择装置 .
(2)从碘水中分离出I2 , 选择装置 , 该分离方法的名称为 .
(3)装置A中①的名称是 , 进水的方向是 .
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如图流程的实验: 
问题1:粗盐中含Ca2+、Mg2+、Fe3+、SO42﹣等杂质,需要提纯后才能综合利用.
粗盐提纯的步骤有:
①加入过量的Na2CO3溶液; ②加入过量的BaCl2溶液; ③加入过量的NaOH溶液;
④调节溶液的pH等于7; ⑤溶解; ⑥过滤; ⑦蒸发.
正确的操作顺序是(填写序号字母).
a.⑤②③①⑥④⑦b.⑤①②③⑥④⑦c.⑤②①③④⑥⑦d.⑤③①②⑥④⑦
问题2:按所选顺序操作时,步骤④的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:根据离子反应,碳酸根离子与钡离子产生碳酸钡沉淀,硫酸根离子与钡离子产生硫酸钡沉淀,而碳酸钡能与盐酸反应,硫酸钡不溶.
现取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀盐酸处理后沉淀量减少到4.66g,并有气体放出.试计算:
(1)所得白色沉淀中BaCO3的物质的量;
(2)原混合液中Na2CO3的物质的量浓度;
(3)产生的气体在标准状况下的体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如下图所示

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体.请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围:________.
(2)A、B、H的化学式:A__________、B__________、 H________.
(3)①H2O2分子的电子式为______________。
②写出C的酸性溶液与双氧水反应的离子方程式: _______________________。
(4)写出鉴定E中阳离子的实验方法和现象:_______________________。
(5)在C溶液中加入与C等物质的量的Na 2 O 2 ,恰好使C转化为F,写出该反应的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合如图变化的是( )

A. CH3CH2OH(g) ![]() CH2=CH2(g)+H2O(g) ΔH>0
CH2=CH2(g)+H2O(g) ΔH>0
B. CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
C. CO2(g)+2NH3(g) ![]() CO(NH2)2(s)+H2O(g) ΔH<0
CO(NH2)2(s)+H2O(g) ΔH<0
D. 2C6H5CH2CH3(g)+O2(g) ![]() 2C6H5CHCH2(g)+2H2O(g)ΔH<0
2C6H5CHCH2(g)+2H2O(g)ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家刚刚发现了某种元素的一个原子,其质量是ag,12C的一个原子质量是bg,NA是阿伏伽德罗常数的值,下列说法正确的是( )
A.该原子的摩尔质量是:aNA
B.Wg该原子的物质的量是: ![]() ?mol
?mol
C.Wg该原子中含有 ![]() ?NA个该原子
?NA个该原子
D.由已知信息可得:NA= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用质量分数为98%、密度为1.84gcm﹣3的浓H2SO4来配制500mL、0.2molL﹣1的稀H2SO4 . 可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙.请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有(填代号).
(2)经计算,需浓H2SO4的体积为mL(保留一位小数).现有①10mL ②50mL ③100mL三种规格的量筒,你选用的量筒是(填代号)
(3)在配制过程中,其他操作都准确,下列操作中:错误的是 , 能引起实验结果偏高的有(填代号).
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com