

A.在阴极式,发生的电极反应为:2H2O+2e- 2OH―+H2↑ 2OH―+H2↑ |
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2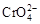 +2H+ +2H+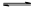 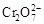 +H2O向右移动 +H2O向右移动 |
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+2O2↑ 2K2Cr2O7+4KOH+2H2↑+2O2↑ |
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α=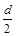 |


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:不详 题型:问答题
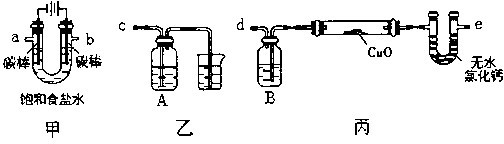
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.35.5:108 | B.16:207 | C.8:1 | D.108:35.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
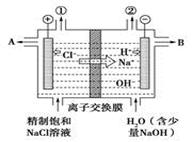
| A.转移电子0.8 mol时产生氢气8.96 L |
| B.从出口B处导出的是氢氧化钠与氯化钠的混合溶液 |
| C.装置中出口①处的气体能使湿润的淀粉碘化钾试纸变蓝 |
| D.装置中的阳离子交换膜防止产生的氯气与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
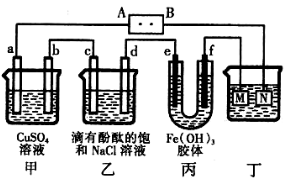
| A.电源B端是正极 |
| B.a、c电极均有单质生成,其物质的量之比为2:1 |
| C.欲用丁装置给铜镀银,N应为Ag,电解液为AgNO3溶液 |
| D.f极附近变红,说明氢氧化铁胶粒带正电荷 |
查看答案和解析>>
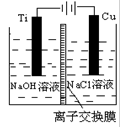
科目:高中化学 来源:不详 题型:单选题
| A.金属腐蚀的本质是金属原子失去电子而被氧化 |
| B.将地下钢管与直流电源的正极相连,用来保护钢管 |
| C.电解饱和食盐水制氢氧化钠,可以用铁做阴极 |
| D.氢氧燃料电池中,氢气在负极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu + H2O  Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
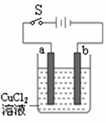
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
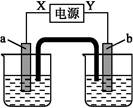
| | a电极 | b电极 | X电极 | 溶液 |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com