
【题目】下列有机物命名正确的是
A.1,2—二甲基戊烷B.2—乙基丁烷
C.2—甲基丁烯D.4,4—二甲基—2—戊烯
科目:高中化学 来源: 题型:
【题目】用如图所示装置检验乙烯时不需要除杂的是( ) 
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4加热至170℃ | NaOH | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4加热至170℃ | NaOH | Br2的CCl4溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiOH是制取锂和锂的化合物的原料,用电解法制备LiOH的工作原理如下图所示:

下列叙述不正确的是
A. b极附近溶液的pH减小
B. a极发生的反应为2H2O-4e-===O2↑+4H+
C. 该法制备LiOH还可得到硫酸和氢气等产品
D. 当电路中通过1mol电子时,可得到1mol LiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬所得铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,实现铬和铝的再生利用。其工作流程如下:

提示:2CrO42-+2H+ ![]() Cr2O72-+H2O
Cr2O72-+H2O
(1)写出过程I中铝发生的离子方方程式_______________。
(2)溶液1中的阴离子有CrO42-、 ___________。
(3)过程I中,Cr2O3参与的反应中,若生成0.4 mol CrO42-,消耗氧化剂的物质的量是________。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,其可用来冶炼Al,冶炼Al原理___________。
②滤渣B受热分解所得物质可以循环利用,B是___________。
(5)过程II的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7。
不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II得到K2Cr2O7粗品的操作是:_______________,过滤得到K2Cr2O7粗品。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为 。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
:步骤2:取 | 无明显现象 |
查阅资料:
ⅰ.SCN-的化学性质与I-相似 ⅱ.2Cu2+ + 4 I-= 2CuI↓+ I2,Cu2+与SCN-反应的离子方程式为 。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL 0.1mol/L FeSO4溶液中加入1 mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2+ + NO ![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO 产生的原因 。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
① 依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ (填“快”或“慢”)。
② 乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是 。
③ 请用化学平衡移动原理解释溶液由棕色变为黄色的原因 。
(5)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请设计实验方案,并画出实验装置图,实现Fe2+![]() Fe3+的转化,同时避免出现此异常现象。
Fe3+的转化,同时避免出现此异常现象。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑
B. 用铜为电极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. FeBr2溶液中通入过量Cl2:2Fe2++Cl2=2Fe3++2Cl-
D. 用FeCl3溶液腐蚀印刷电路板上铜箱:2Fe3++Cu=2Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
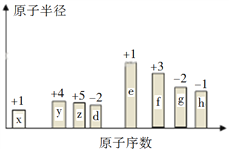
请回答下列问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_________________;比较g、h的最高价氧化物对应的水化物的酸性强弱:________________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1 mol·L1 R溶液的烧杯中滴加1 mol·L1 NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
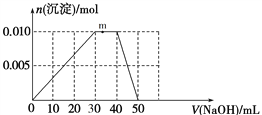
①写出m点反应的离子方程式_____________________________。
②若R溶液改加20 mL1.2 mol·L1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com